Содержание
- 2. ПЕРВАЯ ПОПЫТКА КЛАССИФИКАЦИИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ простые вещества; оксиды (продукты горения простых веществ); кислоты и основания (продукты
- 3. КЛАССИФИКАЦИЯ ПО ТИПУ ХИМИЧЕСКИХ ПРЕВРАЩЕНИЙ КИСЛОТЫ (HNO3, H2SO4, H3PO3, H3AsO4 и др.) ОСНОВАНИЯ (NaOH, NH3, Ca(OH)2,
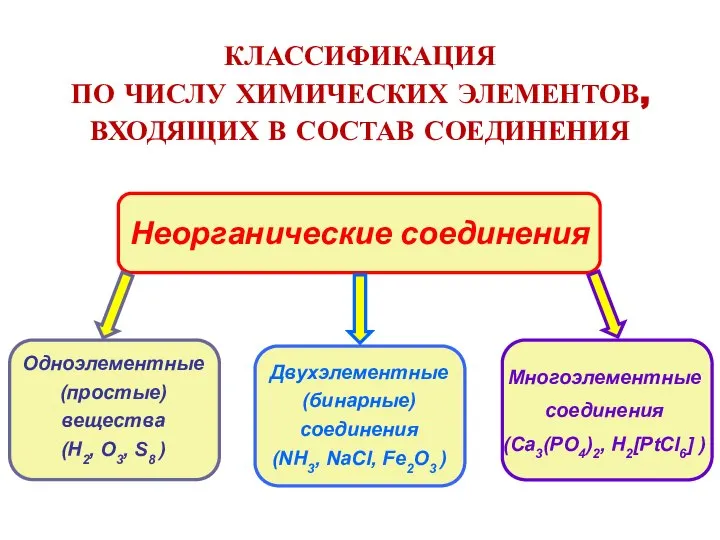
- 4. КЛАССИФИКАЦИЯ ПО ЧИСЛУ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, ВХОДЯЩИХ В СОСТАВ СОЕДИНЕНИЯ
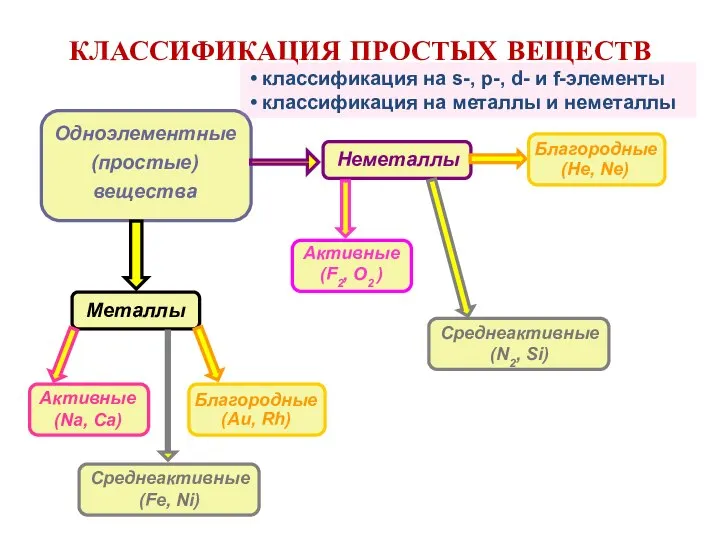
- 5. КЛАССИФИКАЦИЯ ПРОСТЫХ ВЕЩЕСТВ Одноэлементные (простые) вещества Металлы классификация на s-, p-, d- и f-элементы классификация на
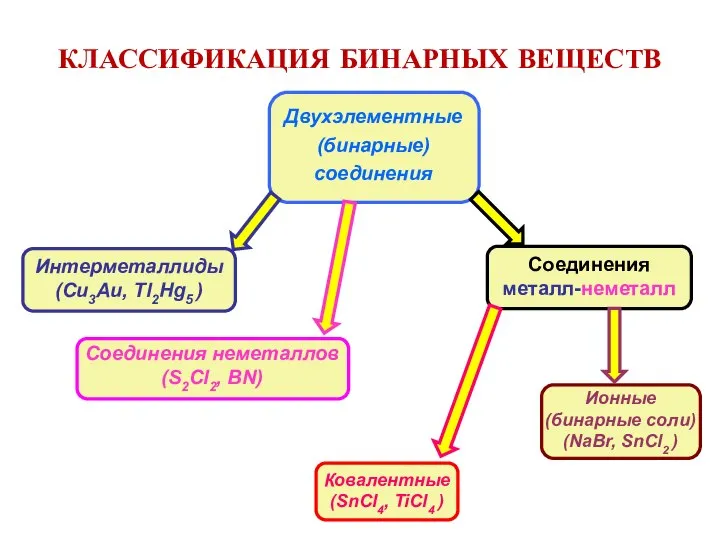
- 6. КЛАССИФИКАЦИЯ БИНАРНЫХ ВЕЩЕСТВ
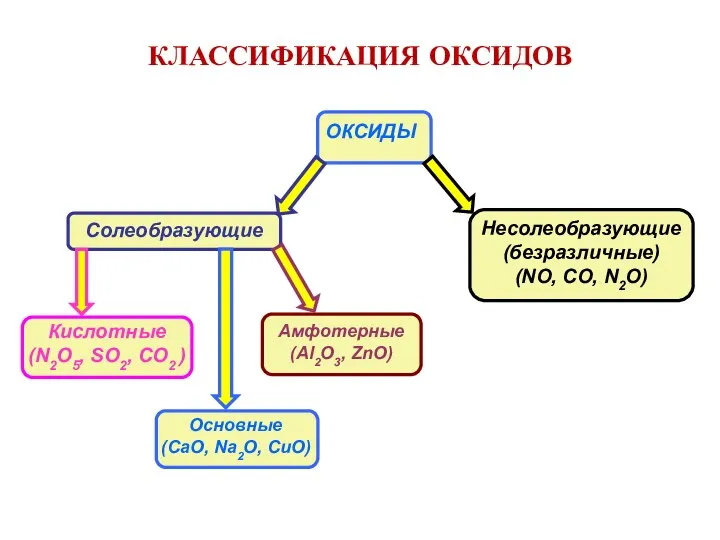
- 7. КЛАССИФИКАЦИЯ ОКСИДОВ
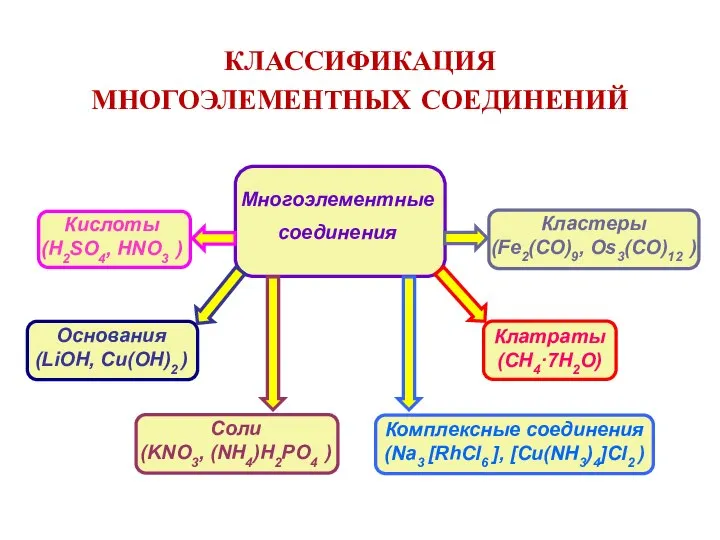
- 8. КЛАССИФИКАЦИЯ МНОГОЭЛЕМЕНТНЫХ СОЕДИНЕНИЙ Соли (KNO3, (NH4)H2PO4 )
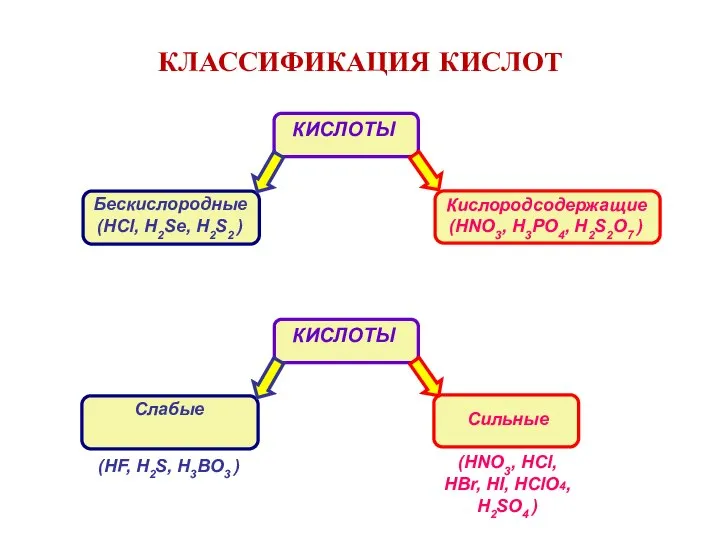
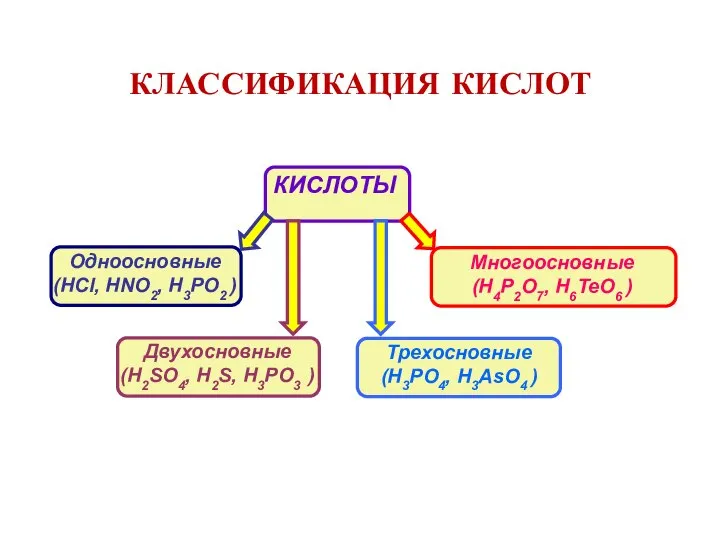
- 9. КЛАССИФИКАЦИЯ КИСЛОТ
- 10. КЛАССИФИКАЦИЯ КИСЛОТ
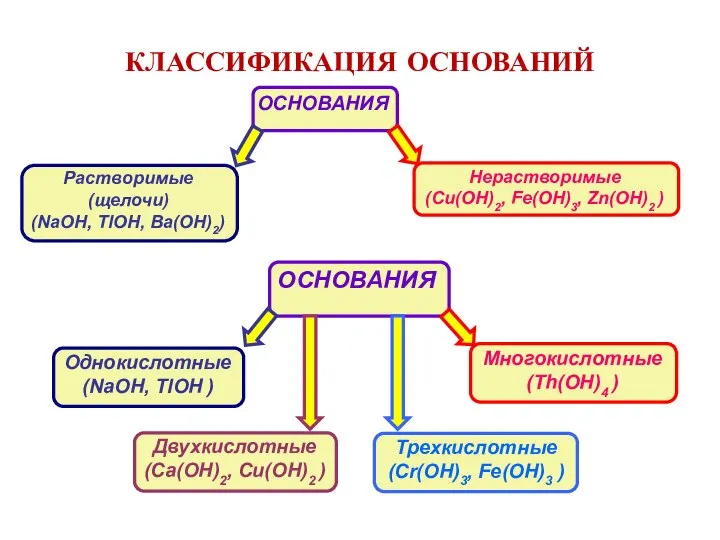
- 11. КЛАССИФИКАЦИЯ ОСНОВАНИЙ
- 12. КЛАССИФИКАЦИЯ СОЛЕЙ Комплексные ( [Cu(NH3)4][PtCl4] ) Смешанные (CaOCl2 (CaCl2⋅Ca(OCl)2) Двойные (CaCO3⋅MgCO3)
- 13. НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 14. ПРАВИЛА ДЛЯ СОСТАВЛЕНИЯ НАЗВАНИЙ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ СИСТЕМАТИЧЕСКАЯ НОМЕНКЛАТУРА (правила комиссии ИЮПАК) ТРАДИЦИОННАЯ НОМЕНКЛАТУРА «РУССКАЯ» НОМЕНКЛАТУРА НЕНОМЕНКЛАТУРНЫЕ
- 15. НАЗВАНИЯ И ОБОЗНАЧЕНИЯ ЭЛЕМЕНТОВ И ИЗОТОПОВ Элементы: символы и названия элементов приведены в ПС. Изотопы: обозначение
- 16. ЗАПИСЬ СИМВОЛОВ ИОНОВ заряд иона – надстрочный индекс справа знак (+ или −) после цифры: SO42−
- 17. НАЗВАНИЯ КАТИОНОВ (правила ИЮПАК) одноэлементные одноатомные катионы: Cu+ – катион меди(I) Cu2+ – катион меди(II) Ba2+
- 18. многоэлементные катионы: UO2+ – катион диоксоурана(V) (HgNO3)+ – катион нитратортути(II) [Ti(H2O)6]3+ – катион гексаакватитана(III) (H3SO4)+ –
- 19. одноэлементные одноатомные анионы: -ид + -ион Cl− – хлорид-ион H− – гидрид-ион S2− – сульфид-ион N3−
- 20. многоэлементные анионы: SO42− – тетраоксосульфат(VI)-ион NO3− – тринитрат(V)-ион РO43− – тетраоксофосфат(V)-ион RuO4− –тетраоксорутенат(VII)-ион специальные названия катионов:
- 21. НАЗВАНИЯ ПРОСТЫХ ВЕЩЕСТВ названия, как правило, происходят от названий соответствующих элементов для твердых аллотропных модификаций: α-,
- 22. МНОГОЭЛЕМЕНТНЫЕ СОЕДИНЕНИЯ ИНТЕРМЕТАЛЛИДЫ запись формулы: первым (слева в формуле) записывают символ металла, который стоит левее в
- 23. СОЕДИНЕНИЯ ДВУХ НЕМЕТАЛЛОВ ИЛИ МЕТАЛЛ-НЕМЕТАЛЛ название (по правилам ИЮПАК) дают справа налево в два слова: первое
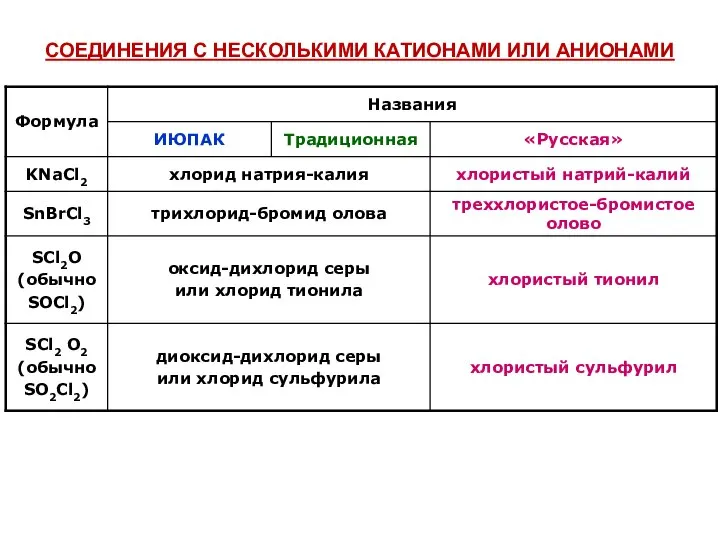
- 24. СОЕДИНЕНИЯ С НЕСКОЛЬКИМИ КАТИОНАМИ ИЛИ АНИОНАМИ
- 25. ПСЕВДОГАЛОГЕНИДЫ псевдогалогены – группы атомов, обладающих галогенидподобными свойствами
- 26. ОКСИДЫ (O2−), ПЕРОКСИДЫ (O22−), НАДПЕРОКСИДЫ (O2−), ОЗОНИДЫ (O3−): название (по правилам ИЮПАК): оксид + название элемента
- 27. ВОДОРОДНЫЕ СОЕДИНЕНИЯ: твердые соединения металл-водород: гидрид LiH – гидрид лития CaH2 – гидрид кальция (BeH2)n –
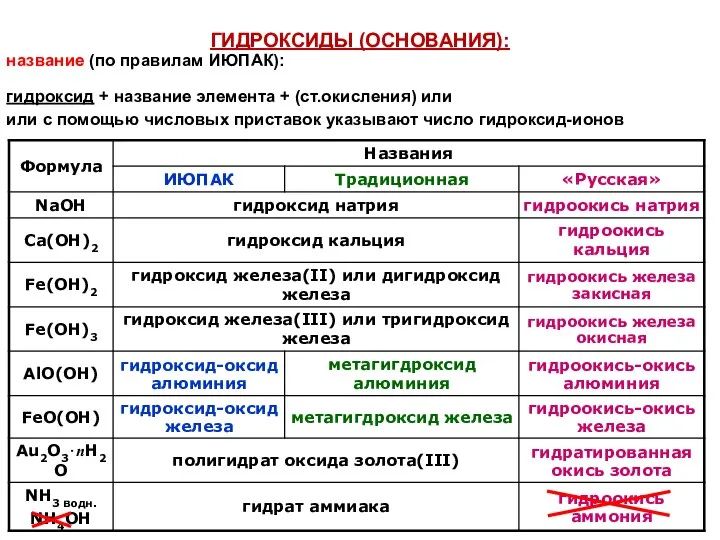
- 28. ГИДРОКСИДЫ (ОСНОВАНИЯ): название (по правилам ИЮПАК): гидроксид + название элемента + (ст.окисления) или или с помощью
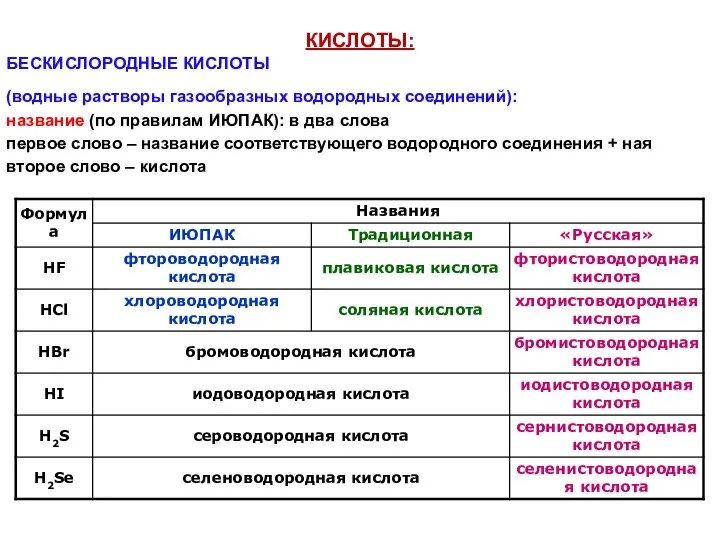
- 29. КИСЛОТЫ: БЕСКИСЛОРОДНЫЕ КИСЛОТЫ (водные растворы газообразных водородных соединений): название (по правилам ИЮПАК): в два слова первое
- 30. КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): в два слова первое слово – название элемента +
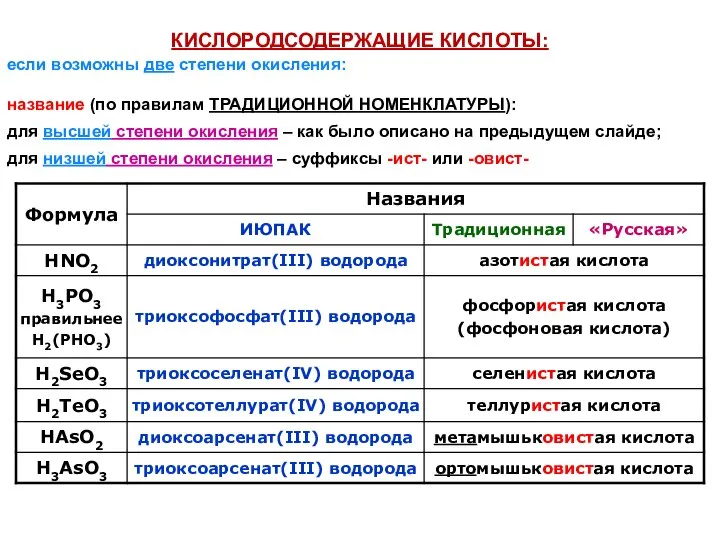
- 31. КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): для высшей степени окисления – как было описано на
- 32. КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): для высшей и средней степени окисления – как было
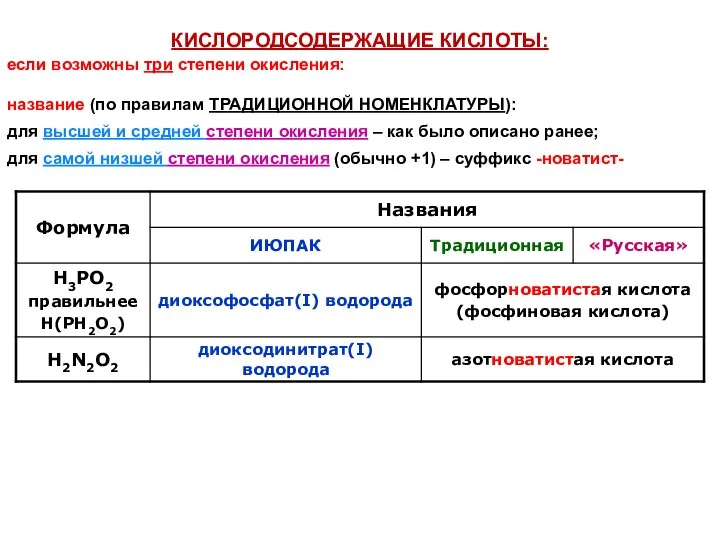
- 33. КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): суффиксы -н-, -новат-, -ист-, -новатист- уменьшение степени окисления «центрального
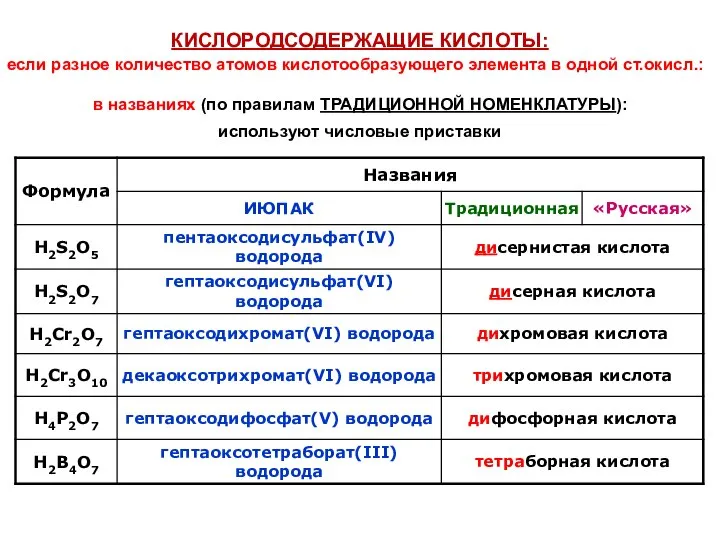
- 34. КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): используют числовые приставки если разное количество атомов кислотообразующего
- 35. ЗАМЕЩЕННЫЕ КИСЛОТЫ на атомы серы: добавляют приставку тио и используют числовые приставки на пероксогруппу (-О-О-): добавляют
- 36. ДРУГИЕ ЗАМЕЩЕННЫЕ КИСЛОТЫ замещается часть групп ОН или атомы О: специальные названия для замещенных серных кислот:
- 37. НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): в два слова первое слово – кислотный
- 38. НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): в два слова первое слово – кислотный
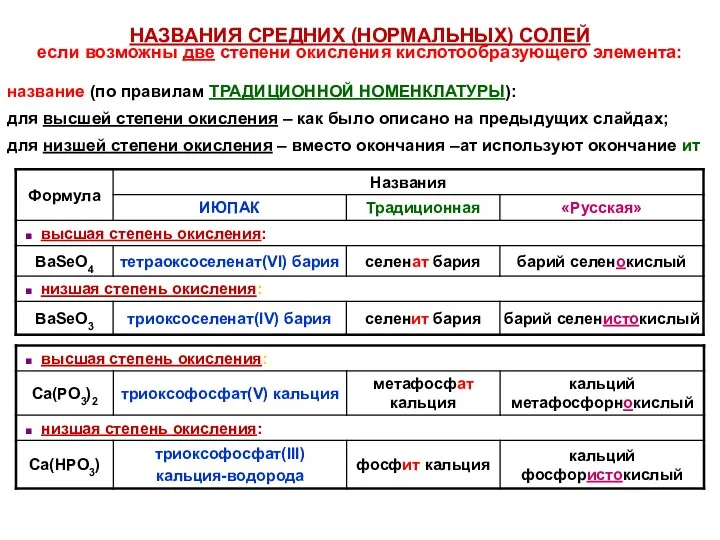
- 39. НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ если возможны две степени окисления кислотообразующего элемента: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
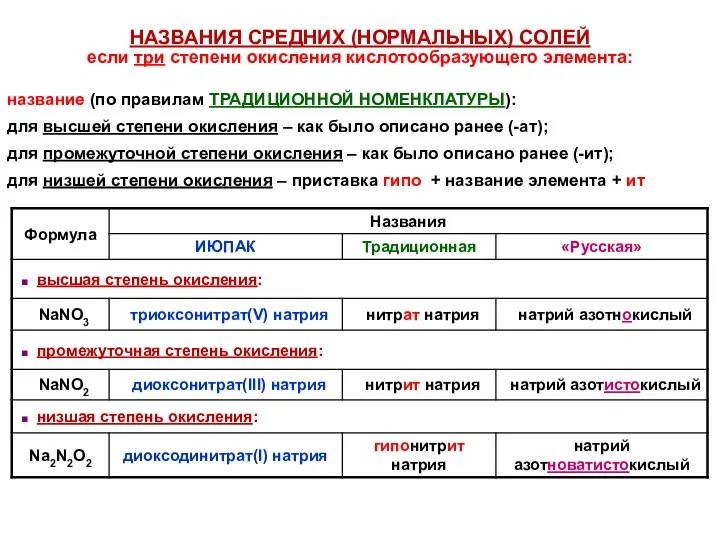
- 40. НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ если три степени окисления кислотообразующего элемента: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): для
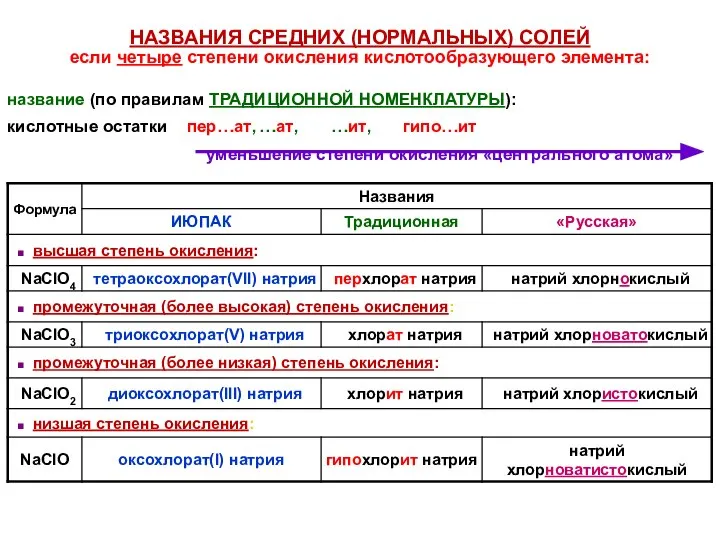
- 41. НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ если четыре степени окисления кислотообразующего элемента: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): кислотные
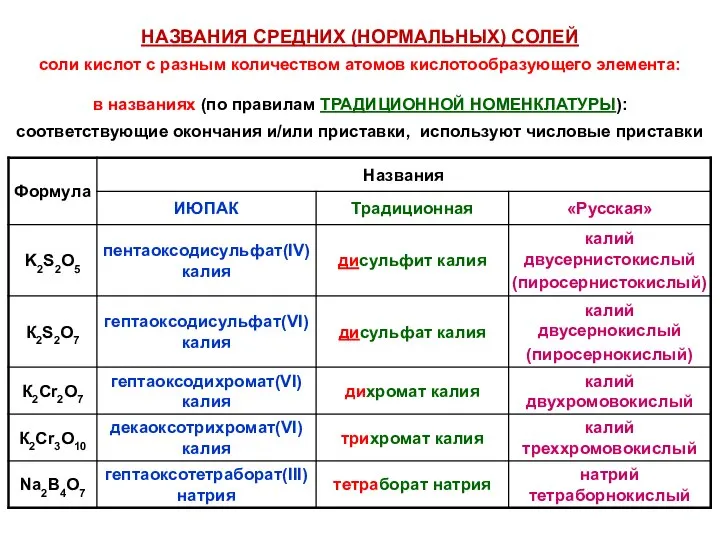
- 42. НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ соли кислот с разным количеством атомов кислотообразующего элемента: в названиях (по правилам
- 43. НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ ЗАМЕЩЕННЫХ КИСЛОТ соли тио- и пероксокислот: в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
- 44. НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ ЗАМЕЩЕННЫХ КИСЛОТ соли других замещенных кислот: в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
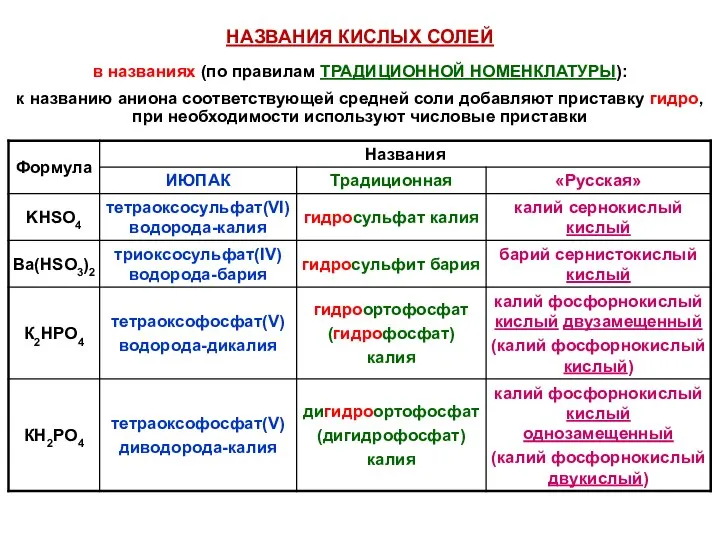
- 45. НАЗВАНИЯ КИСЛЫХ СОЛЕЙ в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): к названию аниона соответствующей средней соли добавляют
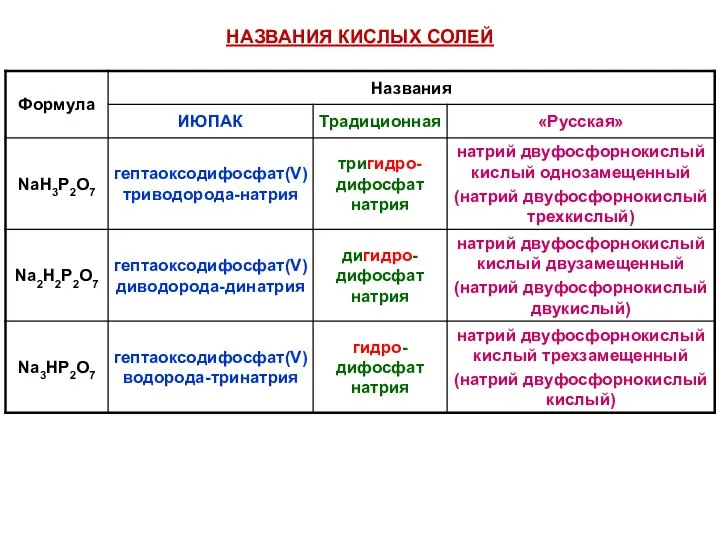
- 46. НАЗВАНИЯ КИСЛЫХ СОЛЕЙ
- 47. НАЗВАНИЯ ОСНόВНЫХ СОЛЕЙ в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): к названию аниона соответствующей средней соли добавляют
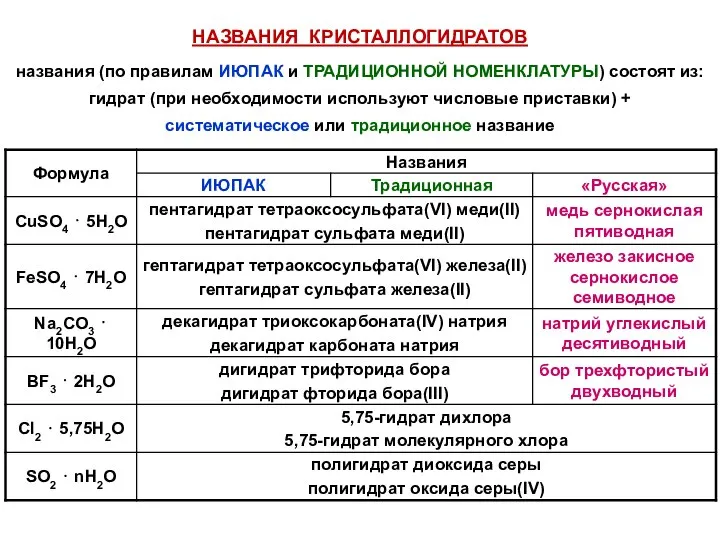
- 48. НАЗВАНИЯ КРИСТАЛЛОГИДРАТОВ названия (по правилам ИЮПАК и ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ) состоят из: гидрат (при необходимости используют числовые
- 49. КВАСЦЫ и ШЁНИТЫ квасцы: двойные сульфаты с общей формулой MI MIII (SO4)2 · 12H2O MI =
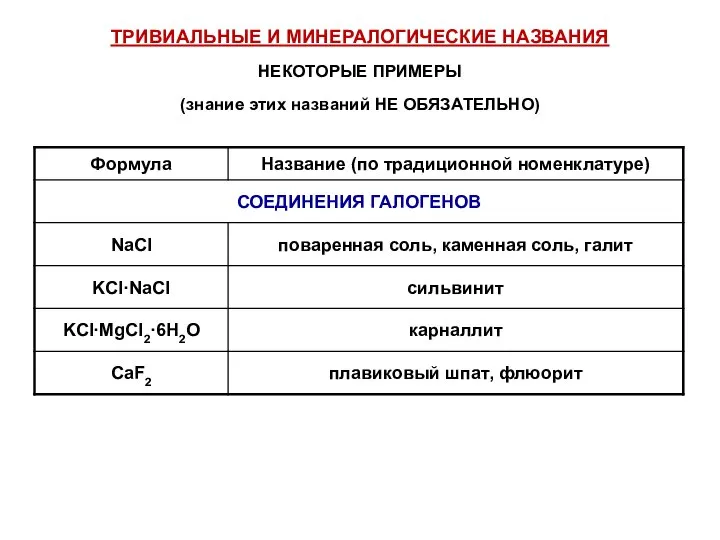
- 50. ТРИВИАЛЬНЫЕ И МИНЕРАЛОГИЧЕСКИЕ НАЗВАНИЯ НЕКОТОРЫЕ ПРИМЕРЫ (знание этих названий НЕ ОБЯЗАТЕЛЬНО)
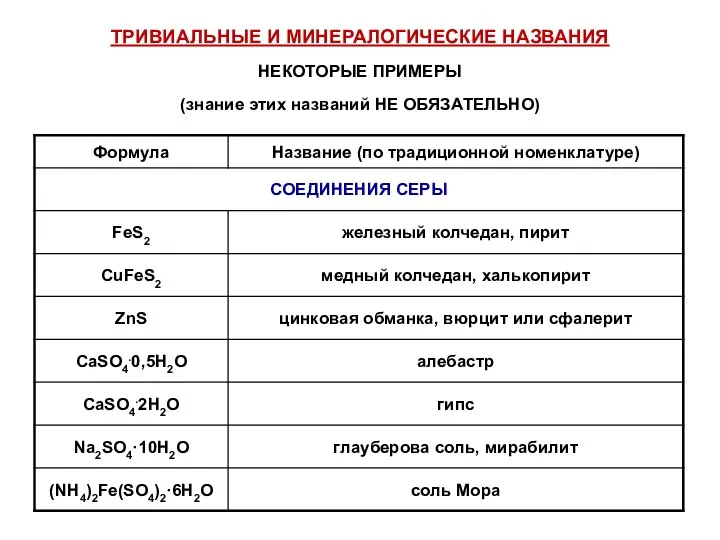
- 51. ТРИВИАЛЬНЫЕ И МИНЕРАЛОГИЧЕСКИЕ НАЗВАНИЯ НЕКОТОРЫЕ ПРИМЕРЫ (знание этих названий НЕ ОБЯЗАТЕЛЬНО)
- 53. Скачать презентацию


![КЛАССИФИКАЦИЯ СОЛЕЙ Комплексные ( [Cu(NH3)4][PtCl4] ) Смешанные (CaOCl2 (CaCl2⋅Ca(OCl)2) Двойные (CaCO3⋅MgCO3)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/976313/slide-11.jpg)





![многоэлементные катионы: UO2+ – катион диоксоурана(V) (HgNO3)+ – катион нитратортути(II) [Ti(H2O)6]3+ –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/976313/slide-17.jpg)


















 Презентация на тему Драгоценные камни
Презентация на тему Драгоценные камни  Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Основания. Классификация. Химические и физические свойства
Основания. Классификация. Химические и физические свойства Теория активированного комплекса
Теория активированного комплекса Органические соединения углеводороды
Органические соединения углеводороды Виды аккумулирования энергии
Виды аккумулирования энергии Что такое эксперимент?
Что такое эксперимент? Предельные углеводороды. Урок №4
Предельные углеводороды. Урок №4 Исследование интерактивной компьютерной химической модели
Исследование интерактивной компьютерной химической модели Сопротивление материалов коррозии
Сопротивление материалов коррозии G12 - класс антифризов
G12 - класс антифризов Органическая химия Жиры
Органическая химия Жиры Проект Волшебство химии
Проект Волшебство химии Строение атома алюминия. Физические и химические свойства алюминия
Строение атома алюминия. Физические и химические свойства алюминия Степень окисления. Составление формул бинарных соединений
Степень окисления. Составление формул бинарных соединений Алканы
Алканы Углеводы. Глюкоза
Углеводы. Глюкоза Стекло. Определение стекла
Стекло. Определение стекла Альдегиды. Получение и применение
Альдегиды. Получение и применение Аналитические методы контроля в техносферной безопасности. Лекция 1
Аналитические методы контроля в техносферной безопасности. Лекция 1 Химия в быту
Химия в быту Новогодний Пробник №190415
Новогодний Пробник №190415 Презентация - Крахмал - подготовительная группа
Презентация - Крахмал - подготовительная группа Кислоты. Строение, классификации и свойства неорганических кислот
Кислоты. Строение, классификации и свойства неорганических кислот Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями)
Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями) Значение коллодиной химии в производстве
Значение коллодиной химии в производстве Получение волокон на основе сверхвысокомолекулярного полиэтилена
Получение волокон на основе сверхвысокомолекулярного полиэтилена Менделеев Дмитрий Иванович
Менделеев Дмитрий Иванович