Содержание
- 2. СОДЕРЖАНИЕ Определение Типы солей,участвующих в гидролизе Алгоритм составления уравнений гидролиза Применение гидролиза Примеры солей,участвующих в гидролизе
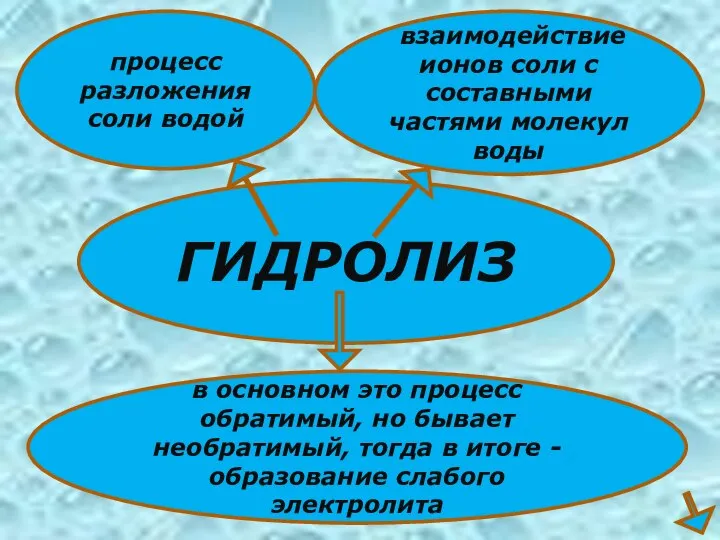
- 3. ГИДРОЛИЗ процесс разложения соли водой взаимодействие ионов соли с составными частями молекул воды в основном это
- 4. Новые понятия Гидролиз – реакция обмена между растворимыми солями и водой Сильные основания – сильные электролиты
- 5. Соль образована сильным основанием и сильной кислотой Соль образована сильным основанием и слабой кислотой Соль образована
- 6. Al(CH3CO2)3
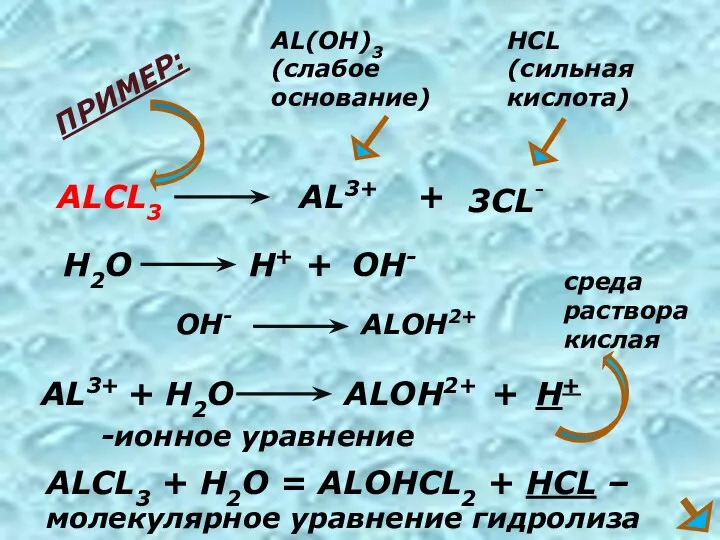
- 7. ALCL3 AL3+ + 3CL- AL(OH)3 (слабое основание) HCL (сильная кислота) AL3+ + H2O H+ OH- ALOH2+
- 8. О Б Р А Т И Т Е В Н И М А Н И Е:
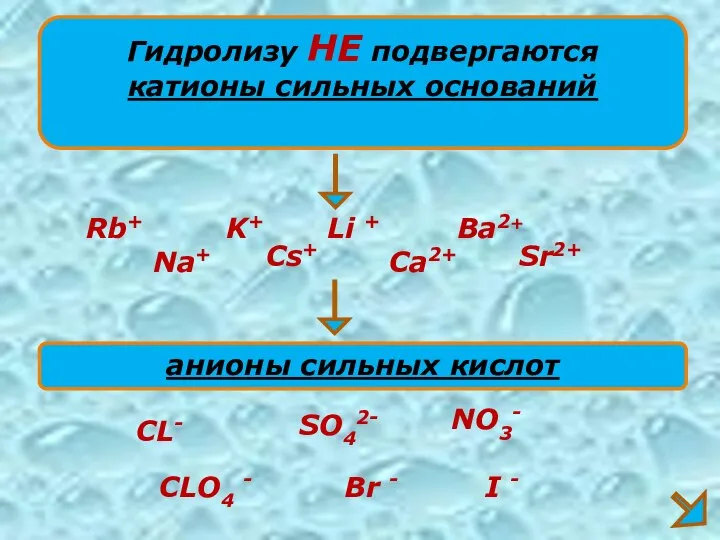
- 9. Гидролизу НЕ подвергаются катионы сильных оснований Na+ K+ Ca2+ анионы сильных кислот CL- SO42- NO3- Ba2+
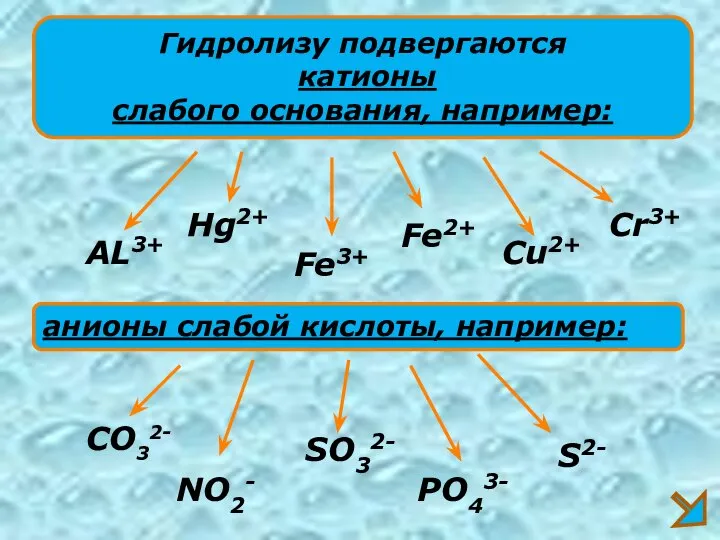
- 10. Гидролизу подвергаются катионы слабого основания, например: AL3+ Fe3+ Cu2+ анионы слабой кислоты, например: CO32- SO32- S2-
- 11. Классификация солей Задание1. Разделите предложенные формулы солей на четыре типа, объясните свой выбор: BaCl2, ZnSO4, CuCl2,
- 12. Алгоритм составления уравнений гидролиза Проверить растворимость соли. Определить состав соли, т.е. указать, каким по силе основанием
- 13. П Р И М Е Р Ы С О Л Е Й, П О Д В
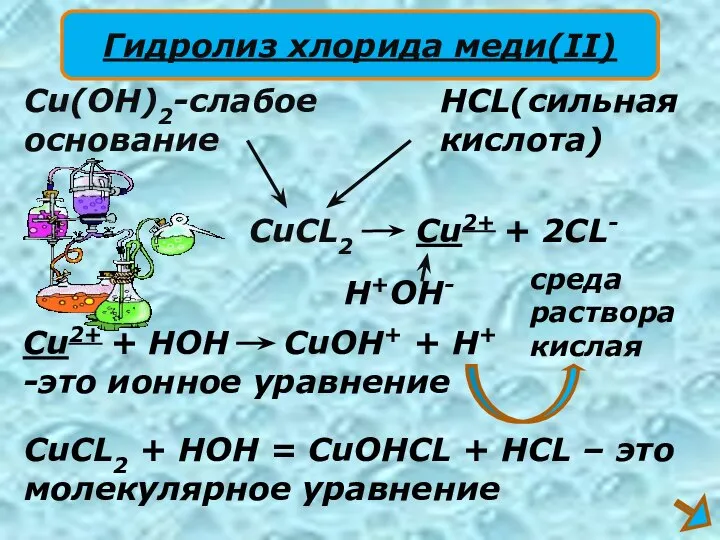
- 14. CuCL2 Cu(OH)2-слабое основание HCL(сильная кислота) Cu2+ + 2CL- H+OH- Cu2+ + HOH CuOH+ + H+ -это
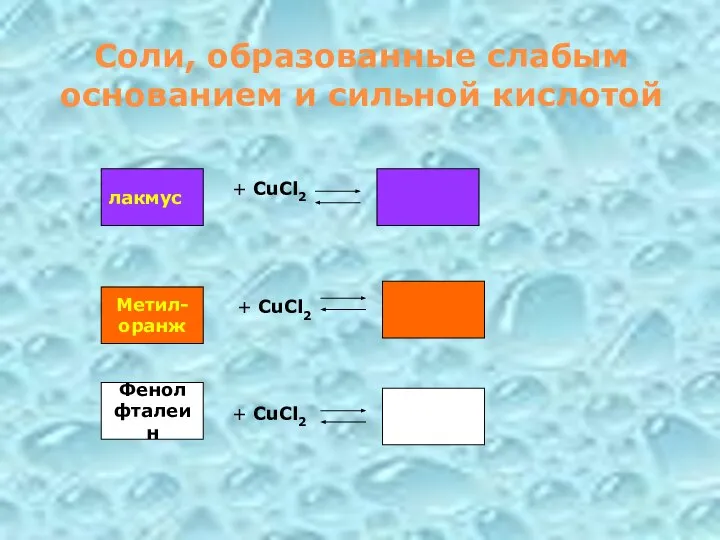
- 15. Соли, образованные слабым основанием и сильной кислотой Фенол фталеин + CuCl2 + CuCl2 + CuCl2 лакмус
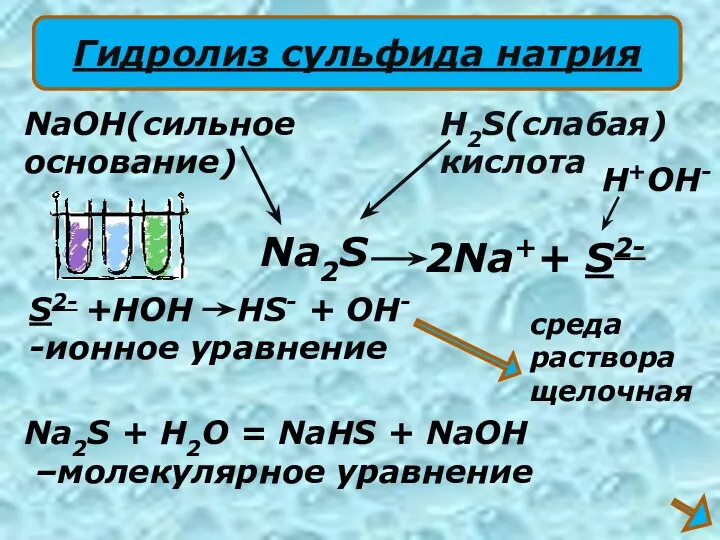
- 16. 2Na++ S2- NaOH(сильное основание) H2S(слабая) кислота S2- +HOH HS- + OH- -ионное уравнение Na2S + H2O
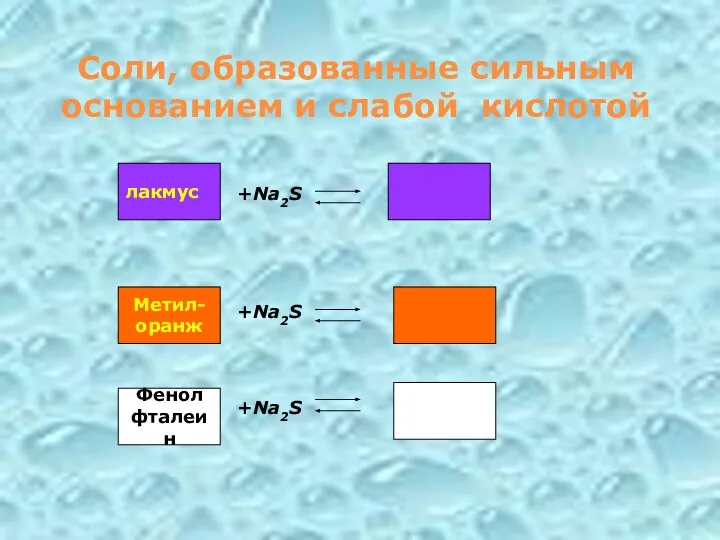
- 17. Соли, образованные сильным основанием и слабой кислотой +Na2S +Na2S +Na2S лакмус Метил- оранж Фенол фталеин
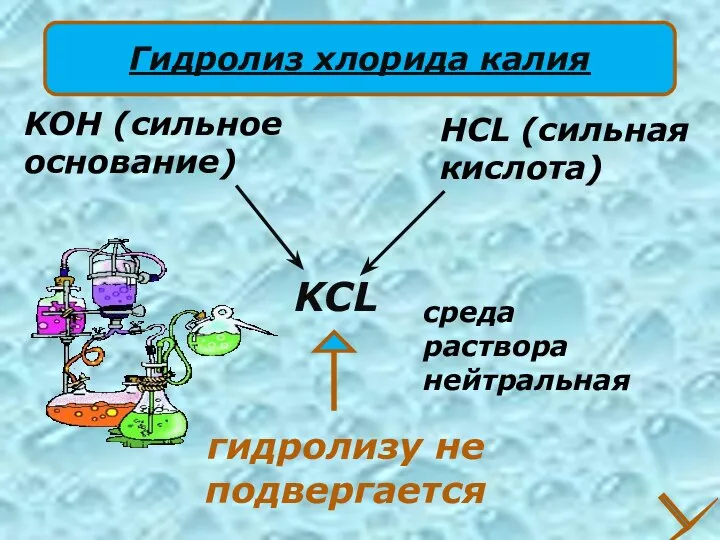
- 18. KCL HCL (сильная кислота) KOH (сильное основание) гидролизу не подвергается среда раствора нейтральная Гидролиз хлорида калия
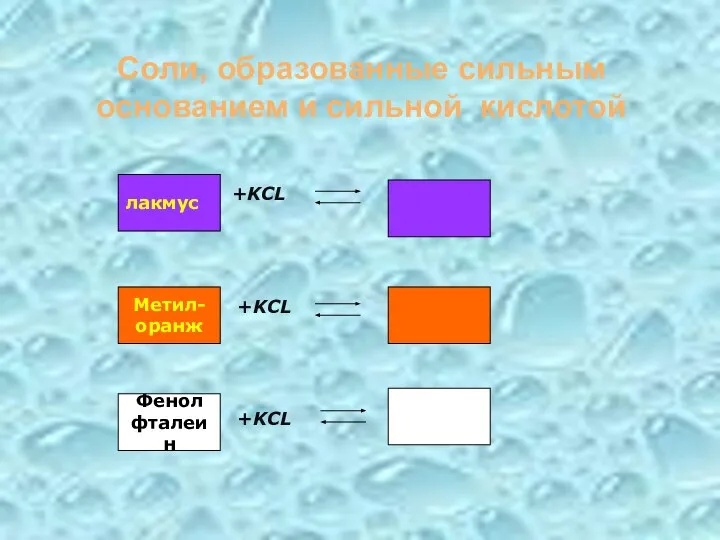
- 19. Соли, образованные сильным основанием и сильной кислотой +KCL +KCL +KCL лакмус Метил- оранж Фенол фталеин
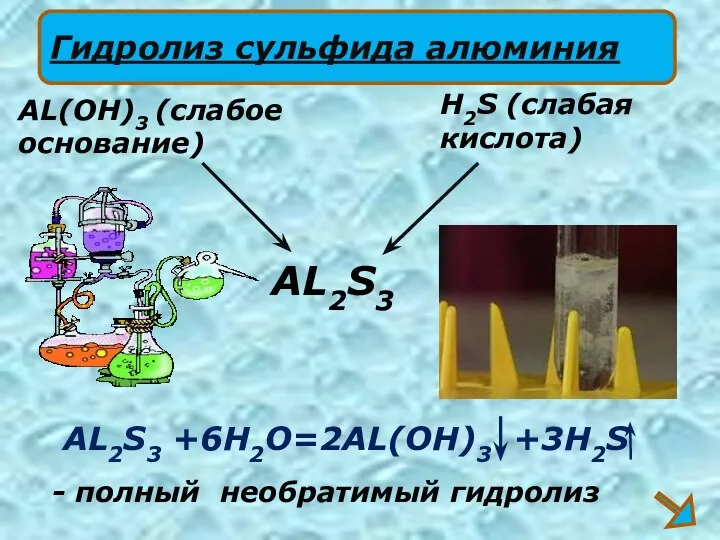
- 20. AL2S3 +6H2O=2AL(OH)3 +3H2S AL2S3 H2S (слабая кислота) AL(OH)3 (слабое основание) Гидролиз сульфида алюминия - полный необратимый
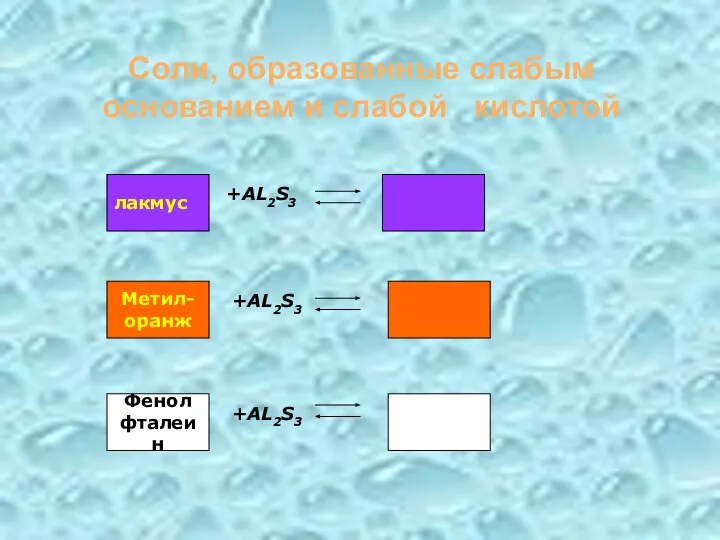
- 21. Соли, образованные слабым основанием и слабой кислотой +AL2S3 +AL2S3 +AL2S3 лакмус Метил- оранж Фенол фталеин
- 22. стирка мытье посуды умывание с мылом Роль гидролиза в повседневной жизни человека
- 23. Для умывания, стирки, мытья посуды нужны синтетические моющие средства, в основе которых содержатся в основном соли
- 24. А ТЕПЕРЬ ВОПРОСЫ….
- 25. В водном растворе какой соли фенолфталеин окрашен в малиновый цвет? 1)CaCl2 2)KNO3 3)FeSO4 4)Na2CO3 Найди верный
- 26. Одинаковую реакцию среды имеют растворы карбоната натрия и 1) нитрата натрия 2) силиката натрия 3) сульфата
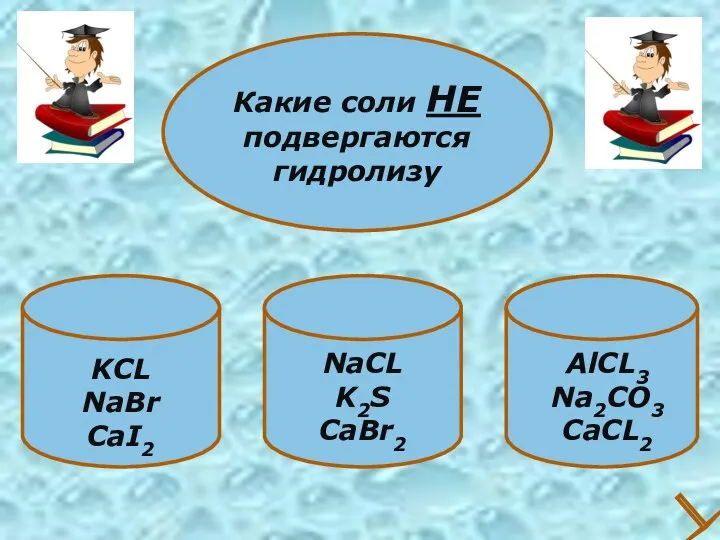
- 27. KCL NaBr CaI2 Какие соли НЕ подвергаются гидролизу NaCL K2S CaBr2 AlCL3 Na2CO3 CaCL2
- 28. В Ы В О Д: Э Т О Н У Ж Н О З Н А
- 29. Домашнее задание
- 30. Нейтральную среду имеет водный раствор: 1)нитрита натрия 2)силиката калия 3)хлорида железа (II) 4)нитрата калия Найди верный
- 32. Скачать презентацию














 Фосфор в природе
Фосфор в природе Основания как электролиты
Основания как электролиты Комплексное изучение системы NiO-ZnO-CoO с целью модифицирования свойств исходной матрицы никель-цинкового феррита xZnxFe2O4
Комплексное изучение системы NiO-ZnO-CoO с целью модифицирования свойств исходной матрицы никель-цинкового феррита xZnxFe2O4 Предельные углеводороды (циклоалканы)
Предельные углеводороды (циклоалканы) Материаловедение. Методы исследования в материаловедении (лекция 1)
Материаловедение. Методы исследования в материаловедении (лекция 1) Химия и Сельское хозяйство
Химия и Сельское хозяйство Электролитическая диссоциация кислот
Электролитическая диссоциация кислот Фуллерены: аллотропы углерода
Фуллерены: аллотропы углерода Основной закон радиоактивного распада и активность радионуклидов
Основной закон радиоактивного распада и активность радионуклидов Ионообменные материалы для сорбции биологически активных веществ
Ионообменные материалы для сорбции биологически активных веществ Каучук, резина
Каучук, резина Теория растворов. (Тема 1.5)
Теория растворов. (Тема 1.5)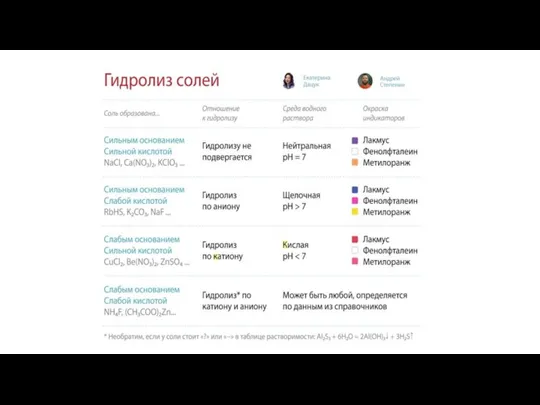 Гидролиз солей
Гидролиз солей Химия функциональных материалов. Адсорбция
Химия функциональных материалов. Адсорбция Алканы. Химические свойства, получение и особенности
Алканы. Химические свойства, получение и особенности Растворы. Процесс растворения (1)
Растворы. Процесс растворения (1) Мицеллобразование (2)
Мицеллобразование (2) Свойства металлов. Лекция №8
Свойства металлов. Лекция №8 Систематизация знаний по периодической системе химических элементов
Систематизация знаний по периодической системе химических элементов Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах
Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах Презентация на тему Знаешь ли ты классы неорганических веществ
Презентация на тему Знаешь ли ты классы неорганических веществ  Теория валентных связей
Теория валентных связей Моделирование деформаций углеродных слоёв при функционализации технического углерода
Моделирование деформаций углеродных слоёв при функционализации технического углерода Примеры методов разделения белков (фракционирования)
Примеры методов разделения белков (фракционирования) Участь антиоксидантної системи saccharomyces cerevisiae у горметичному ефекті пероксиду водню
Участь антиоксидантної системи saccharomyces cerevisiae у горметичному ефекті пероксиду водню Теория электролитической диссоциации
Теория электролитической диссоциации Сера
Сера Биодизельное топливо
Биодизельное топливо