Содержание
- 2. Диссоциация воды H2O ⇄ H+ + OH– НО! Ионное произведение воды Постоянно для всех разбавленных растворов!
- 4. Водородный показатель (pH) pH = –lg[H+] Лакмус Лакмус Метил-оранж Метил-оранж Фенол-фталеин Фенол-фталеин H2O ⇄ H+ +
- 5. Значения рН некоторых растворов
- 6. Степень гидратации различных ионов и молекул неодинакова и зависит от размеров частиц и величины их заряда.
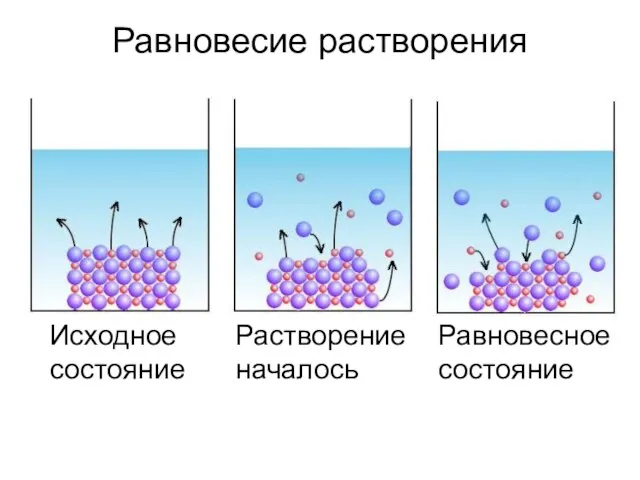
- 7. Равновесие растворения Исходное состояние Растворение началось Равновесное состояние
- 8. Константа (произведение) растворимости KtxAny(к) ⇄ xKty+(р) + yAnx–(р) Применима только к малорастворимым и нерастворимым электролитам! В
- 9. Расчет растворимости по Ks a) В чистой воде AgCl(к) ⇄ Ag+(р) + Cl–(р) (размерность моль2/дм2 подразумевается,
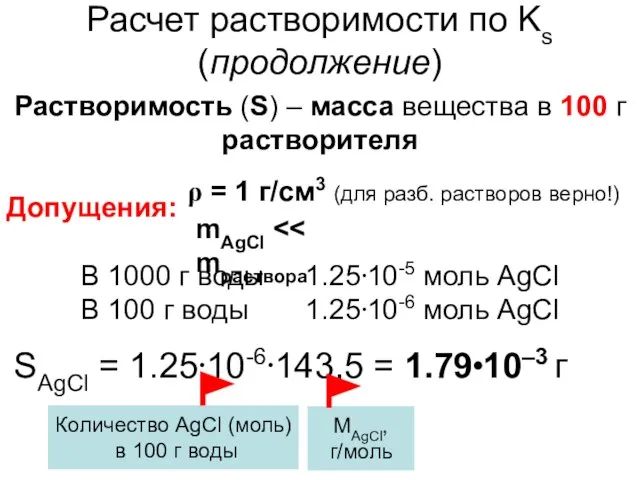
- 10. Расчет растворимости по Ks (продолжение) Растворимость (S) – масса вещества в 100 г растворителя Допущения: ρ
- 11. Расчет растворимости солей с многозарядными ионами Ca3(PO4)2 ⇄ 3Ca2+ + 2PO43– = 1.13∙10-7∙310 = 3.53∙10–5 г/дм3
- 12. Способы смещения равновесия растворимости Повышение температуры – S↑ Добавление одноименного иона – S↓ Добавление реагента, участвующего
- 13. Влияние одноименных ионов KtxAny(к) ⇄ xKty+(р) + yAnx–(р) Повышение концентрации Kty+ Автоматически снижается концентрация Anx–! (произведение
- 14. Расчет растворимости по Ks б) В растворе с одноименным ионом: Рассчитаем SAgCl в 0,01М растворе NaCl
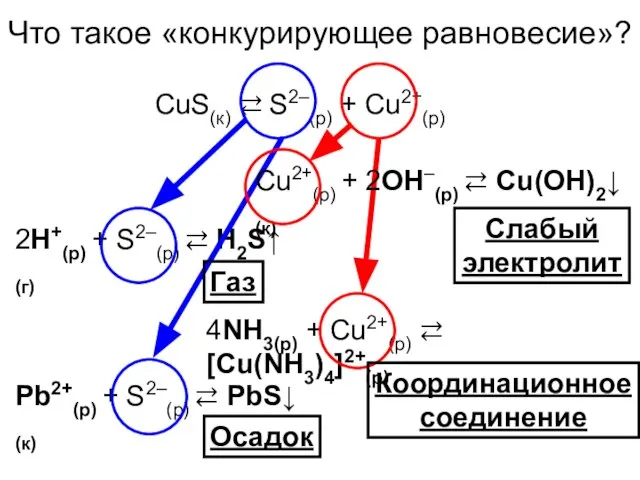
- 15. Что такое «конкурирующее равновесие»? CuS(к) ⇄ S2–(р) + Cu2+(р) 2H+(р) + S2–(р) ⇄ H2S↑(г) Pb2+(р) +
- 20. Скачать презентацию


![Водородный показатель (pH) pH = –lg[H+] Лакмус Лакмус Метил-оранж Метил-оранж Фенол-фталеин Фенол-фталеин](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/903254/slide-3.jpg)










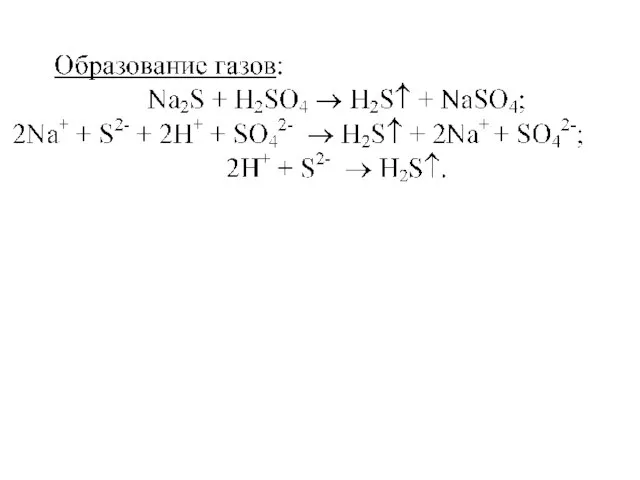
 Алкены.Номенклатура
Алкены.Номенклатура Химическая организация клетки
Химическая организация клетки Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Практическая работа. Решение экспериментальных задач по неорганической химии с использованием виртуальной лаборатории
Практическая работа. Решение экспериментальных задач по неорганической химии с использованием виртуальной лаборатории Гармонизации терминологии аналитической химии с использованием электронной системы на основе MS WSS (Windows SharePoint Services) Широкова В.И.,
Гармонизации терминологии аналитической химии с использованием электронной системы на основе MS WSS (Windows SharePoint Services) Широкова В.И.,  Комплексные соединения
Комплексные соединения Драгоценный металл золото
Драгоценный металл золото Теория химического строения А. М. Бутлерова
Теория химического строения А. М. Бутлерова Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Образование растворов ВМС
Образование растворов ВМС 4. Диаграмма железо-углерод
4. Диаграмма железо-углерод Производство серной кислоты
Производство серной кислоты Типы кристаллических решёток
Типы кристаллических решёток Презентация на тему Химические синонимы
Презентация на тему Химические синонимы  Реакции замещения
Реакции замещения Дидактическое сопровождение курса Мир органических соединений
Дидактическое сопровождение курса Мир органических соединений Алкены. Строение, номенклатура, изомерия
Алкены. Строение, номенклатура, изомерия Структура и функции нуклеиновых кислот
Структура и функции нуклеиновых кислот Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах
Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах Графит (С)
Графит (С) Строение атома
Строение атома Электролиз расплавов и растворов солей
Электролиз расплавов и растворов солей Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея
Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея  Геохимический барьер
Геохимический барьер Презентация на тему Зеленая химия и проблемы устойчивого развития
Презентация на тему Зеленая химия и проблемы устойчивого развития  Значение химии в медицине
Значение химии в медицине Спирты. Строение, классификация, изомерия, физические свойства
Спирты. Строение, классификация, изомерия, физические свойства Решение задач ЕГЭ
Решение задач ЕГЭ