Слайд 2Формулировка Периодического закона
Свойства элементов, а также формы и свойства их соединений

находятся в периодической зависимости от величины их атомных весов
Слайд 3Нарушение закономерности
Co – Ni
Ar – K
Te - I

Слайд 4Важная закономерность
( на основании работ Генри Мозли – Англия,1914г.)
Порядковый номер элемента равен

заряду ядра атома
№ - порядковый номер элемента
Z – заряд ядра атома
Слайд 8В природе существуют атомы одного и того же элемента с различной массой(А)

- изотопы
Слайд 9Вычисление атомной массы элемента
Ar (Cl) = 35 ∙ 0,75 + 37∙ 0,25=35,5

Слайд 12Запомнить!
Атомы одного элемента, имеющие одинаковое число протонов, но различное число нейтронов, называются

изотопами.
Изотопы имеют одинаковые химические свойства, но немного различаются по физическим свойствам, в частности по весу.
Большинство элементов встречаются в природе в виде нескольких изотопов.











 Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Реакции ионного обмена. Задания. 9 класс
Реакции ионного обмена. Задания. 9 класс Кислоты. Классификация кислот
Кислоты. Классификация кислот Основы химической термодинамики
Основы химической термодинамики Викторина Что это?
Викторина Что это? Типы химических реакций. Реакции разложения, реакции соединения.8 класс
Типы химических реакций. Реакции разложения, реакции соединения.8 класс Пластификация пластмасс
Пластификация пластмасс Влияние на скорость ферментативной реакции
Влияние на скорость ферментативной реакции Молекулы. Свойства молекул
Молекулы. Свойства молекул Протолитическая теория кислот и оснований. Буферные растворы
Протолитическая теория кислот и оснований. Буферные растворы Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов
Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов Ионные уравнения
Ионные уравнения Современные химические топливные элементы
Современные химические топливные элементы Презентация на тему Минеральные вещества
Презентация на тему Минеральные вещества  Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого
Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого Ренгеноструктурный и рентгеноспектральный анализы
Ренгеноструктурный и рентгеноспектральный анализы Алкины. Пропин
Алкины. Пропин Электролитическая диссоциация
Электролитическая диссоциация Химические реакции
Химические реакции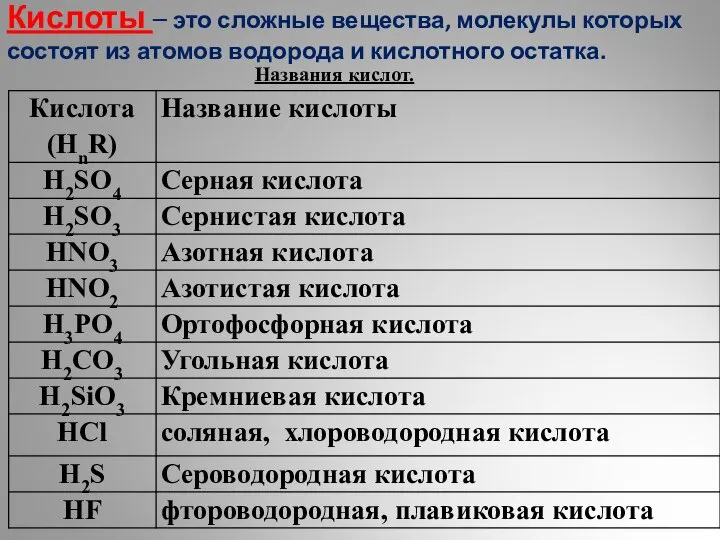 Кислоты. Классификация
Кислоты. Классификация Радиоактивные превращения. Закон радиоактивного распада. Период полураспада
Радиоактивные превращения. Закон радиоактивного распада. Период полураспада Способы защиты химического оборудования от коррозии
Способы защиты химического оборудования от коррозии Вычисление массовой доли химического элемента в веществе
Вычисление массовой доли химического элемента в веществе Общая характеристика металлов
Общая характеристика металлов Разминка для болельщиков
Разминка для болельщиков Строение электронных оболочек
Строение электронных оболочек Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева
Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева Презентация на тему Химические свойства кислот
Презентация на тему Химические свойства кислот