Содержание
- 2. План: Скорость химической реакции Гетерогенные и гомогенные реакции Зависимость скорости реакции от различных факторов: Природа реагирующих
- 3. Скорость химической реакции Обозначается ν 1 моль/л∙с 1 кмоль/м3∙мин определяется изменением концентрации одного из реагирующих веществ
- 4. Раздел химии, изучающий скорость химической реакции, называется химической кинетикой.
- 5. Гетерогенные реакции Это реакции идущие между веществами в неоднородной среде. Например, на поверхности соприкосновения твердого вещества
- 6. Гомогенные реакции Это реакции протекающие в однородной среде(нет поверхности раздела реагирующих веществ). Например в смеси газов
- 7. Факторы, влияющие на скорость химической реакции природа реагирующих веществ; концентрация реагирующих веществ поверхность соприкосновения реагирующих веществ
- 8. 1. Природа реагирующих веществ. Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в
- 9. Теория столкновений. Основная идея теории: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией. Чем
- 10. 2. Концентрации реагирующих веществ. На основе большого экспериментального материала в 1867 г. норвежские учёные К. Гульдберг,
- 11. Закон действующих масс. Гульдберг (1836-1902). Норвежский физикохимик. П. Вааге (1833-1900). Норвежский ученый. V=kcAacBb Скорость химической реакции
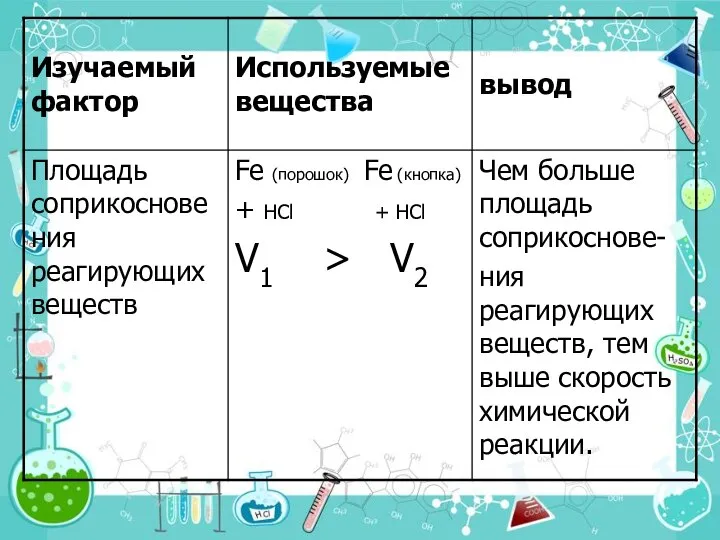
- 12. 3.Поверхность соприкосновения реагирующих веществ. Скорость реакции увеличивается благодаря: -увеличению площади поверхности соприкосновения реагентов (измельчение); -повышению реакционной
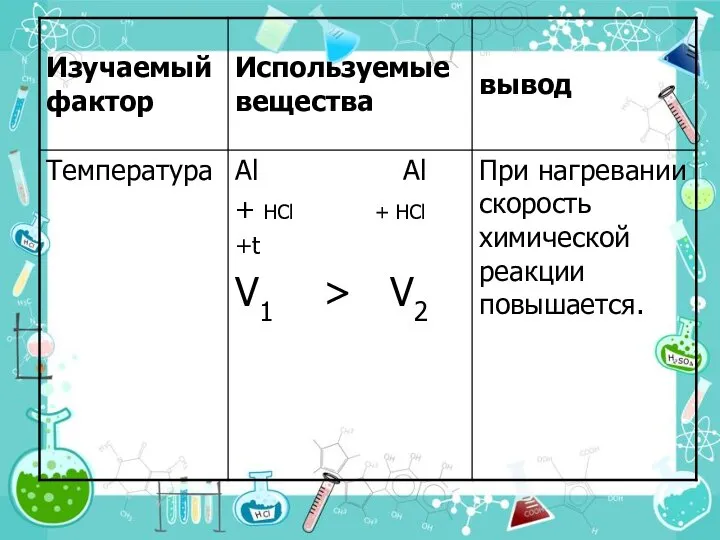
- 14. 4. Температура При увеличении температуры на каждые 10° С общее число столкновений увеличивается только на ~
- 15. Правило Вант-Гоффа Я. Вант-Гофф (1852 -1911). Голландский химик. Один из основателей физической химии и стереохимии При
- 17. 5. Действие катализатора Можно изменить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют
- 18. Различают два вида катализа: Гомогенный катализ, при котором и катализатор, и реагирующие вещества находятся в одном
- 21. Скачать презентацию
















 X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии
X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии Презентация на тему Угольная кислота
Презентация на тему Угольная кислота  Интересные факты о меди
Интересные факты о меди Л-1 основные классы неорганических веществ
Л-1 основные классы неорганических веществ rastvory_-_kopia
rastvory_-_kopia Увлекательный мир науки и практики
Увлекательный мир науки и практики Игра по химии Классики
Игра по химии Классики Металлы 1 А - группы. Щелочные металлы
Металлы 1 А - группы. Щелочные металлы Основания
Основания Повторение по химии (8 класс)
Повторение по химии (8 класс) Азот. Нахождение в природе
Азот. Нахождение в природе Особенности строения вещества. Лекция №2. Строение кристаллов
Особенности строения вещества. Лекция №2. Строение кристаллов Алкадиены. Строение. Гомологический ряд. Изомерия. Номенклатура
Алкадиены. Строение. Гомологический ряд. Изомерия. Номенклатура Известная и неизвестная вода
Известная и неизвестная вода Карбонильные соединения – альдегиды
Карбонильные соединения – альдегиды Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов
Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов Расчет по химическим уравнениям
Расчет по химическим уравнениям Типы химических реакций
Типы химических реакций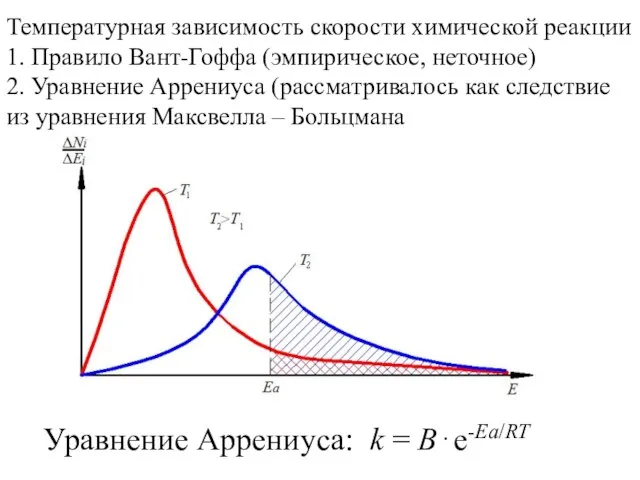 Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции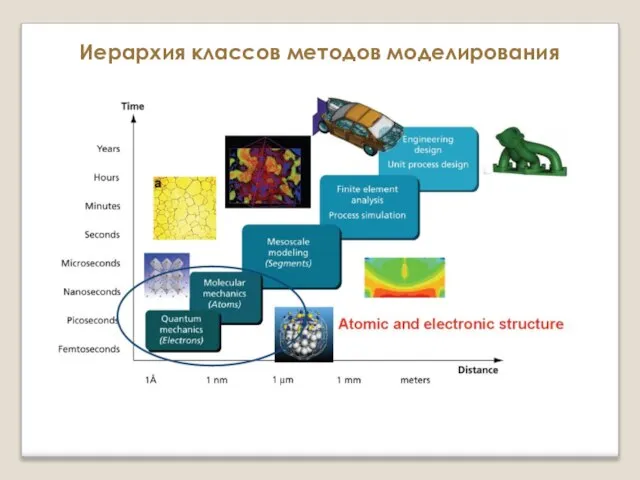 Поверхность потенциальной энергии и расчет сил, действующих на ионы
Поверхность потенциальной энергии и расчет сил, действующих на ионы Химическая кинетика. Основные понятия. Основы формальной кинетики
Химическая кинетика. Основные понятия. Основы формальной кинетики Признаки химических реакций
Признаки химических реакций prezentatsiya-po-fizike-7-klass-tri-agregatnyh-sostoyaniya-veshchestva
prezentatsiya-po-fizike-7-klass-tri-agregatnyh-sostoyaniya-veshchestva Твердые электролиты
Твердые электролиты Алкены
Алкены Сульфиды
Сульфиды Электролитическая диссоциация кислот
Электролитическая диссоциация кислот Звездный час. Конкурс химиков
Звездный час. Конкурс химиков