Содержание
- 2. Строение молекулы CnH2n Химические свойства Изомерия Физические свойства Проверка знаний Получение Номенклатура Применение Алкены
- 3. Алкены – ациклические углеводороды, в молекуле которых кроме одинарных связей содержится одна двойная связь между атомами
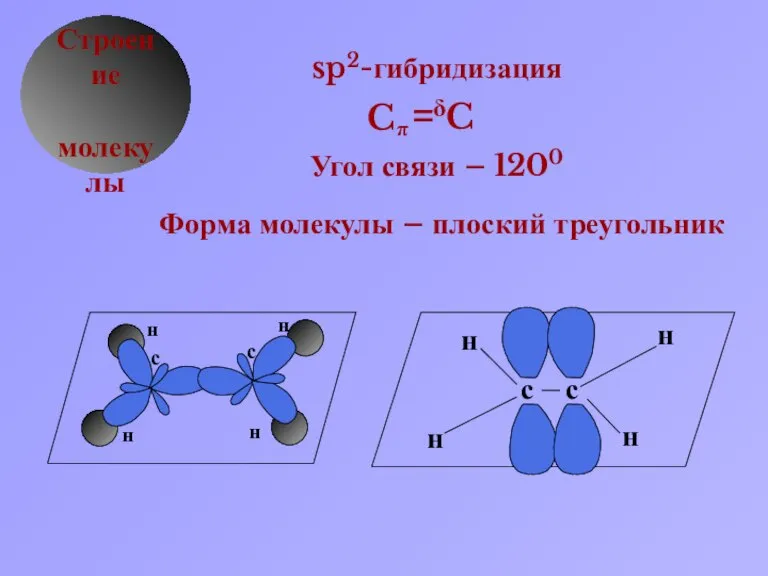
- 4. δ Строение молекулы sp2-гибридизация Угол связи – 1200 Форма молекулы – плоский треугольник C π C
- 5. Н С Номенклатура 1. Выбор главной цепи. Н Н3 С С С С С СН3 Н
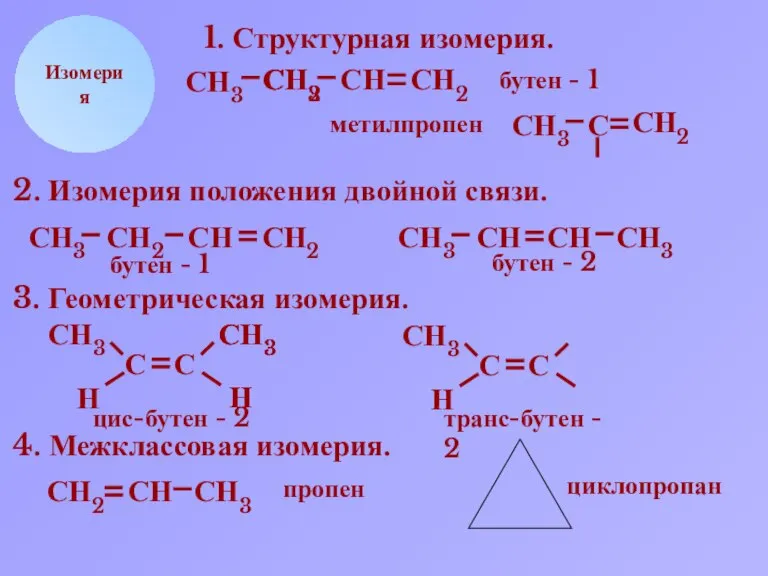
- 6. СН2 СН СН3 Н Изомерия 1. Структурная изомерия. СН2 СН3 С СН2 СН3 С СН2 бутен
- 7. Физические свойства Агрегатное состояние: С2Н4 – С4Н8 газообразные вещества; С5Н10 – С18Н36 жидкости; с С19Н38 твердые
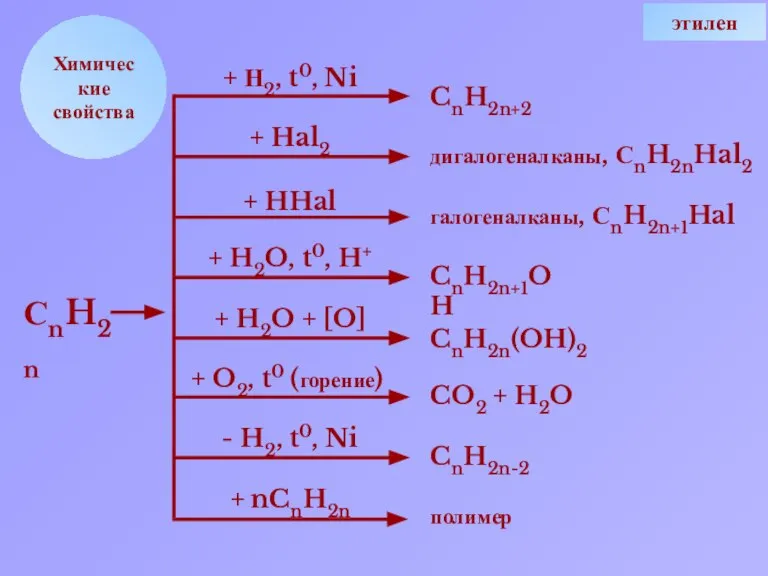
- 8. Химические свойства + Н2, t0, Ni + Hal2 + HHal + H2O, t0, H+ + H2O
- 9. СН ОН 4. Гидратация: Pt, t Химические свойства этилена 1. Гидрирование: СН2 СН2 + Н2 СН3
- 10. Br СН2 Получение 1. Крекинг нефтепродуктов: С16Н34 С8Н18 + С8Н16 2. Дегидрирование предельных углеводородов: СН3 СН2
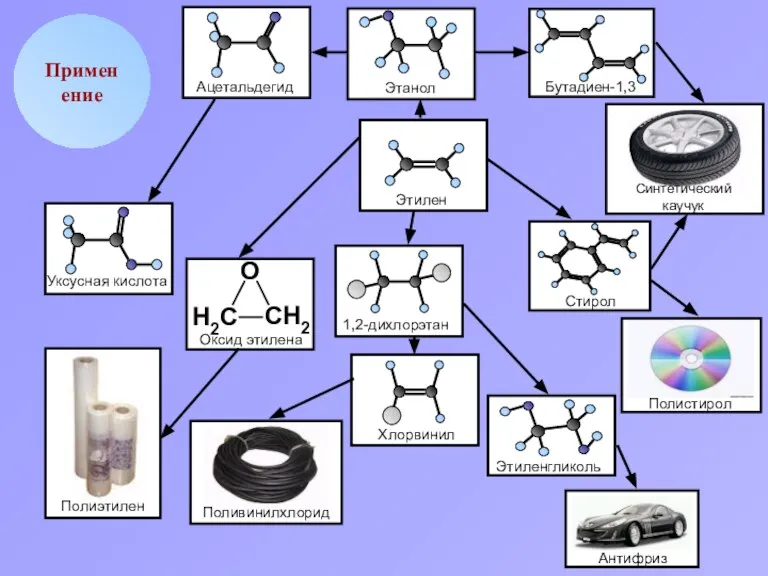
- 11. Применение
- 13. Скачать презентацию





 Презентация на тему Железо 9 класс
Презентация на тему Железо 9 класс  Атомның электрондық құрылысы
Атомның электрондық құрылысы Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Карбонаты (3)
Карбонаты (3) Лабораторное оборудование, посуда и средства защиты
Лабораторное оборудование, посуда и средства защиты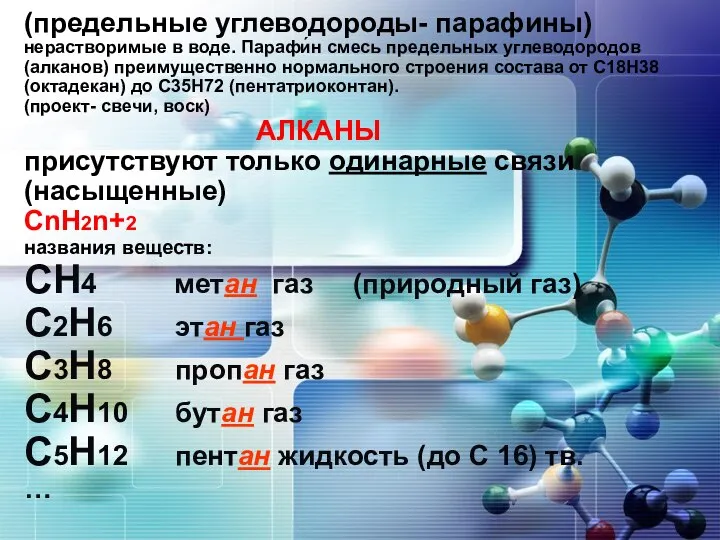 Углеводороды
Углеводороды Практика по химии
Практика по химии Нуклеиновые кислоты
Нуклеиновые кислоты Материалы космической техники
Материалы космической техники Презентация на тему Подгруппа углерода
Презентация на тему Подгруппа углерода  Химия и автомобиль
Химия и автомобиль Дизельное топливо
Дизельное топливо Химическое многоборье. 9 класс
Химическое многоборье. 9 класс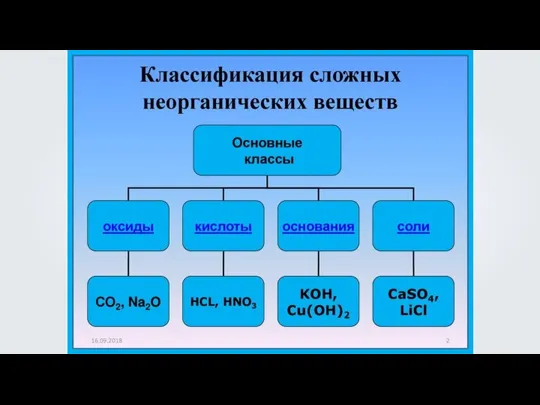 Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Нуклеиновые кислоты
Нуклеиновые кислоты Металлы. Обобщающий урок
Металлы. Обобщающий урок Природный и попутные нефтяные газы
Природный и попутные нефтяные газы Химическая связь
Химическая связь Презентация на тему Алканы
Презентация на тему Алканы  metally_mikhaylets
metally_mikhaylets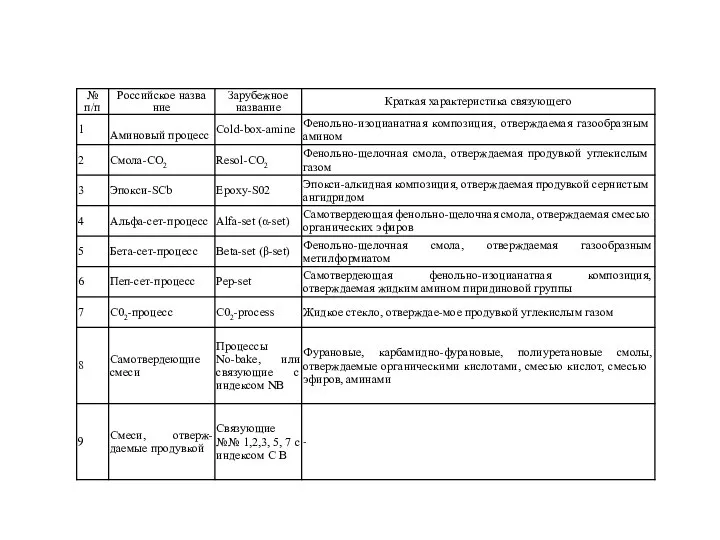 Фенольно-изоцианатная композиция
Фенольно-изоцианатная композиция Каучук. История открытия каучука
Каучук. История открытия каучука Изомерия органических соединений. Лекция 2
Изомерия органических соединений. Лекция 2 Углерод
Углерод Возможности модернизации совместного производства фенола и ацетона кумольным способом
Возможности модернизации совместного производства фенола и ацетона кумольным способом Склероглюкан
Склероглюкан Основания
Основания Необратимый (совместный) гидролиз
Необратимый (совместный) гидролиз