Содержание
- 2. Химик реакция (Химическая реакция или химическое явление) – бирелгән матдәләрнең бүтән үзлекләргә ия булган башка матдәләргә
- 3. Бирем: Сезгә бирелгән текст белән танышырга. Анда тасвирланган химик реакциянең тигезләмәсен язарга. Реакциядә катнашкан матдәләргә исем
- 4. Җавап: CaCO3 + 2 CH3COOH = (CH3COO)2Ca + CO2 + H2O CaCO3 кальций карбонаты (тоз), CH3COOH
- 5. 2 тур Бирем: Тимер белән бакыр сульфаты арасындагы химик реакцияне үткәрегез. Аңа барлык классификацион билгеләр буенча
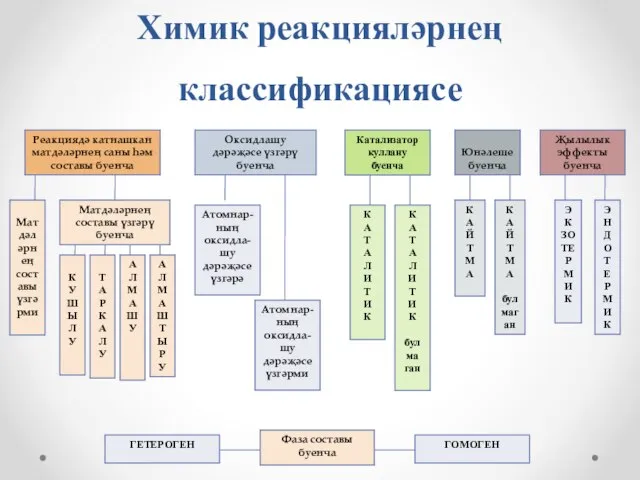
- 6. Химик реакцияләрнең классификациясе
- 7. Җавап: CuSO4 (эремә)+ Fe (каты) → Cu (каты) + FeSO4 (эремә) 1. Алмаштыру реакциясе (реакция замещения).
- 8. Бирем: Сезгә тәгъдим ителгән реактивлардан CuSO4, NaOH, BaCl2, H2SO4, FeCl3 зәңгәрсу (1 нче төркем), ак (2
- 9. FeCl3 + 3NaOH →Fe(OH)3 ↓ + 3 NaCl молекуляр тигезләмә Fe3+ + 3Cl- +3Na+ + 3OH-
- 10. Бирем: Сезгә 3 пробирка бирелгән. Өчесенә дә KMnO4 эремәсе салыгыз. 1 нче пробиркага H2SO4 эремәсе, 2
- 11. Алгоритм записи метода электронного балланса. Составить схему реакции. Определить, атомы каких элементов изме-няют степени окисления. Составить
- 12. Җавап: 2 KMnO4 + 5 K2SO3 + 3 H2SO4 → 2 MnSO4 + 6 K2 SO4
- 13. Бирем: Сезгә бирелгән тоз эремәләренең характерын билгеләгез һәм ни өчен шулай икәнен аңлатыгыз: Na2CO3 1 төркем
- 14. Гидролиз
- 15. Җавап: Na2CO3 1 баскыч: Гидролиз тигезләмәсе кыскартылгын ионлы формада: CO32- + H2O ↔ HCO3- + OH-
- 16. Биремнәрне башкарыгыз: 1. Химик реакция булып тора: а) шәм януы; б) бензинның очуы; в) бозның эрүе;
- 17. Дөрес җаваплар:
- 19. Скачать презентацию















 Personal сare. Akypo Foam Rl 40
Personal сare. Akypo Foam Rl 40 Физико-химические методы анализа. Лекция 4
Физико-химические методы анализа. Лекция 4 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Процессы переработки нефти
Процессы переработки нефти Введение Химия. Вещество. Свойства вещества
Введение Химия. Вещество. Свойства вещества Пакет заданий №2. Команда вечерний дозор
Пакет заданий №2. Команда вечерний дозор Металлическая, водородная, Ван-дер-ваальсова химические связи
Металлическая, водородная, Ван-дер-ваальсова химические связи Строение атома. Планетарная модель атома Резерфорда
Строение атома. Планетарная модель атома Резерфорда Алюминий
Алюминий Обобщение знаний об углеводородах
Обобщение знаний об углеводородах Количественный анализ. Титрование
Количественный анализ. Титрование Аллотропные модификации углерода
Аллотропные модификации углерода Презентация на тему Подготовка к ЕГЭ. Полезно знать
Презентация на тему Подготовка к ЕГЭ. Полезно знать  Презентация на тему Уксусная кислота
Презентация на тему Уксусная кислота  Тефлон
Тефлон Презентация на тему Строение атома Химическая связь
Презентация на тему Строение атома Химическая связь  Кислоты. Общая формула кислот
Кислоты. Общая формула кислот Полимеры
Полимеры Известняк. Разновидности известняка. Области применения
Известняк. Разновидности известняка. Области применения Азот
Азот Химические реакции
Химические реакции Магнитный момент атома. Периодическая система элементов Д.И. Менделеева
Магнитный момент атома. Периодическая система элементов Д.И. Менделеева Закон эквивалентов
Закон эквивалентов Презентация на тему Ферменты и гормоны
Презентация на тему Ферменты и гормоны  Превращение веществ. История химии. Автор: Рассказова Н.Л., учитель химии и биологии МОУ «СОШ №8».
Превращение веществ. История химии. Автор: Рассказова Н.Л., учитель химии и биологии МОУ «СОШ №8». Organiskā ķīmija
Organiskā ķīmija Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем
Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем