Содержание
- 2. Теория электролитической диссоциации была создана шведским ученым С. Аррениусом в 1883 году Механизм электролитической диссоциации был
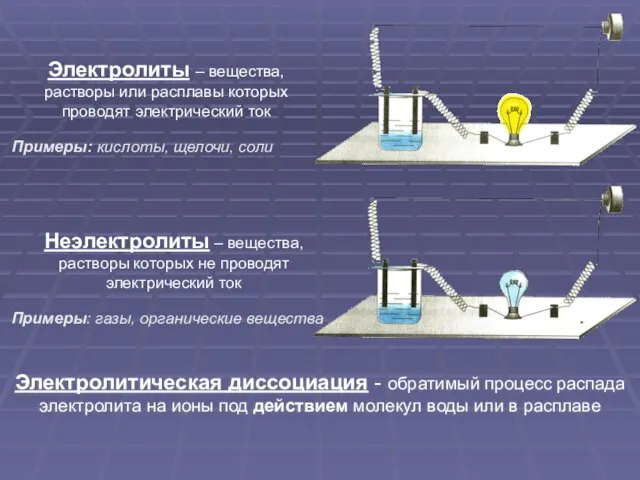
- 3. Электролиты – вещества, растворы или расплавы которых проводят электрический ток Неэлектролиты – вещества, растворы которых не
- 4. Молекулы воды представляют собой диполи, так как атомы водорода расположены под углом 104,5 градуса, благодаря чему
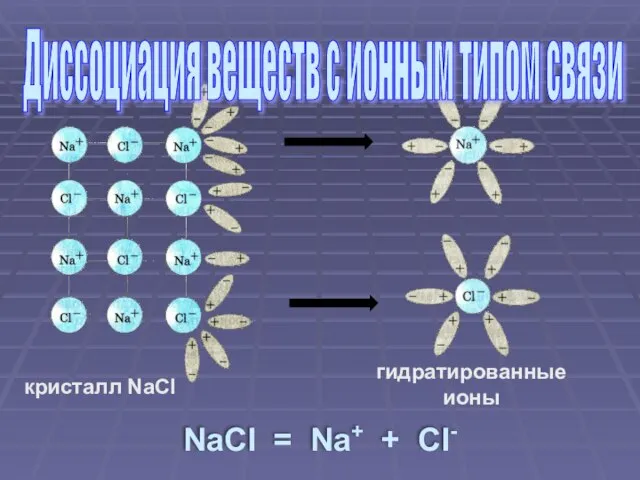
- 5. кристалл NaCl гидратированные ионы NaCl = Na+ + Cl- Диссоциация веществ с ионным типом связи
- 6. Ориентация молекул – диполей воды около ионов кристалла Взаимодействие молекул воды с противоположно заряженными ионами поверхностного
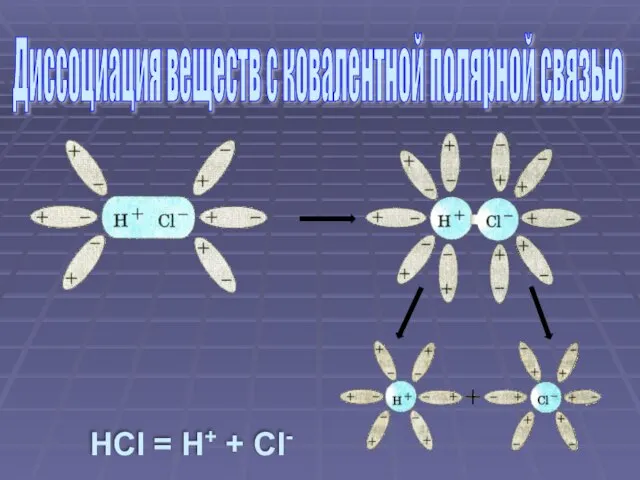
- 7. HCl = H+ + Cl- Диссоциация веществ с ковалентной полярной связью
- 8. Ориентация молекул воды вокруг полюсов молекулы электролита Взаимодействие молекул воды с противоположно заряженными ионами поверхностного слоя
- 9. слабые > 30 % сильные 2 − 30 % средней силы Степень электролитической диссоциации зависит от
- 10. Основные положения теории электролитической диссоциации При растворении в воде электролиты диссоциируют на положительные и отрицательные ионы
- 11. HSO3− H+ + SO32− Кислоты – электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного
- 12. Основания – электролиты, которые при диссоциации образуют катионы металла и анионы гидроксогрупп ОН- NaOH = Na+
- 13. Средние соли – сильные электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+) и анионы
- 15. Скачать презентацию









 Основания. Простые и сложные ионы
Основания. Простые и сложные ионы Биохимия витаминов и коферментов
Биохимия витаминов и коферментов Аммиак. Азот
Аммиак. Азот Влияние спиртов на организм человека
Влияние спиртов на организм человека Дифференцированный подход в преподавании химии
Дифференцированный подход в преподавании химии Оксиды. Классификация
Оксиды. Классификация Презентация на тему Путешествие по континенту Химия, познавательная игра по химии, 8 класс
Презентация на тему Путешествие по континенту Химия, познавательная игра по химии, 8 класс  VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии
VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов
Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов Презентация на тему Угольная кислота и её соли (9 класс)
Презентация на тему Угольная кислота и её соли (9 класс)  Химическая картина мира
Химическая картина мира углеводы (1)
углеводы (1) Презентация на тему Подгруппа углерода и азота
Презентация на тему Подгруппа углерода и азота  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация по Химии "Классификация реакций в неорганической химии"
Презентация по Химии "Классификация реакций в неорганической химии"  Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства
Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства Презентация на тему Степень окисления
Презентация на тему Степень окисления  Всё о нефти. Часть 5
Всё о нефти. Часть 5 Классы неорганических соединений
Классы неорганических соединений Азотистые основания. Нуклеозиды. Нуклеотиды. Нуклеиновые кислоты. Лекция 7
Азотистые основания. Нуклеозиды. Нуклеотиды. Нуклеиновые кислоты. Лекция 7 Строение атома
Строение атома Химия и космос
Химия и космос История развития химии
История развития химии 10_Valentnost_khimicheskikh_elementov
10_Valentnost_khimicheskikh_elementov Сложные неорганические вещества
Сложные неорганические вещества Физические свойства алкенов
Физические свойства алкенов Полиамидное волокно-энант
Полиамидное волокно-энант Создание учебно-методических материалов по химии в современной форме (презентации уроков)
Создание учебно-методических материалов по химии в современной форме (презентации уроков)