Содержание
- 2. План Химические свойства А) Реакции присоединения Б) Реакции окисления В) Реакции замещения в «боковой цепи».
- 3. Химические свойства I.Реакции присоединения 1. Гидрирование (р.восстановления) Kt СН2 = СН2 + Н2 СН3 - СН3
- 4. Химические свойства ВЫВОД: Гидрирование алкенов является реакцией обратимой дегидрированию алканов СnH2n + H2 ↔ CnH2n+2 Гидрирование
- 5. Химические свойства I. Реакции присоединения 2.Галогенирование (бромирование) СН2 = СН2 + Вr2 СН2Вr - СН2Вr При
- 6. Химические свойства I. Реакции присоединения 3.Гидрогалогенирование СН3 -СН= СН2 + НВr CН3 -СНВr- СН3 По правилу
- 7. Химические свойства I. Реакции присоединения 4.а)Гидратация СН2 = СН2 + Н2О СН3 - СН2ОН первичный спирт
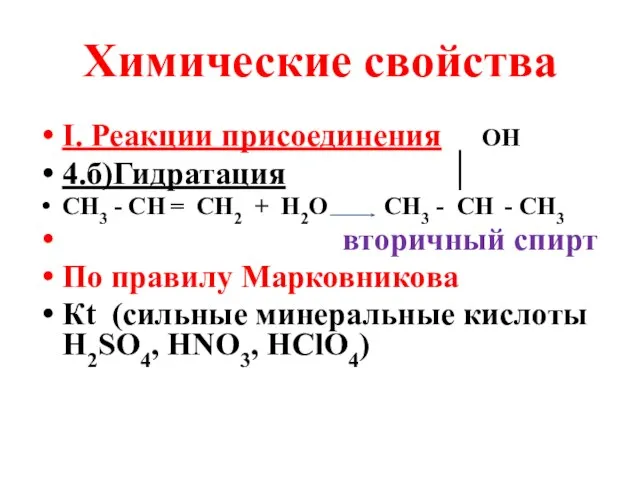
- 8. Химические свойства I. Реакции присоединения ОН 4.б)Гидратация СН3 - СН = СН2 + Н2О СН3 -
- 9. Химические свойства I. Реакции присоединения 5.Полимеризация УФ, R . nСН2 = СН2 ( …-СН2 – СН2
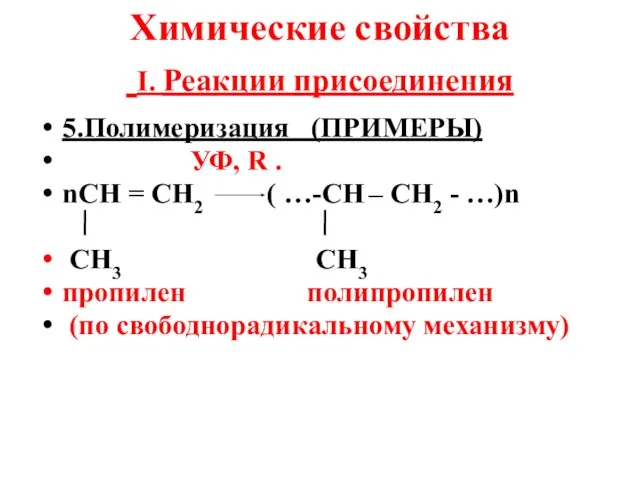
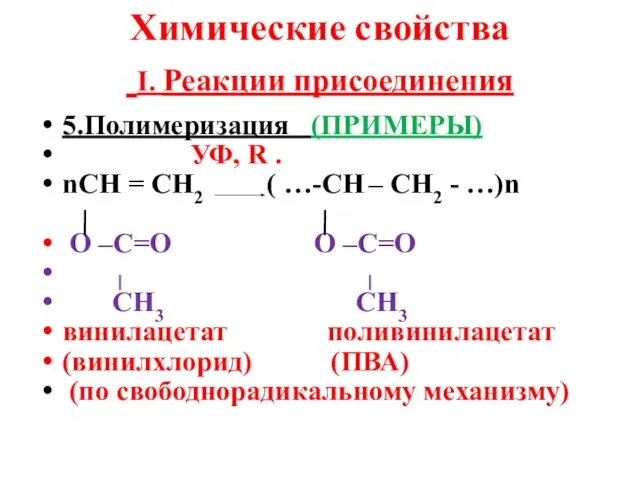
- 10. Химические свойства I. Реакции присоединения 5.Полимеризация (ПРИМЕРЫ) УФ, R . nСН = СН2 ( …-СН –
- 11. Группа винил - СН = СН2
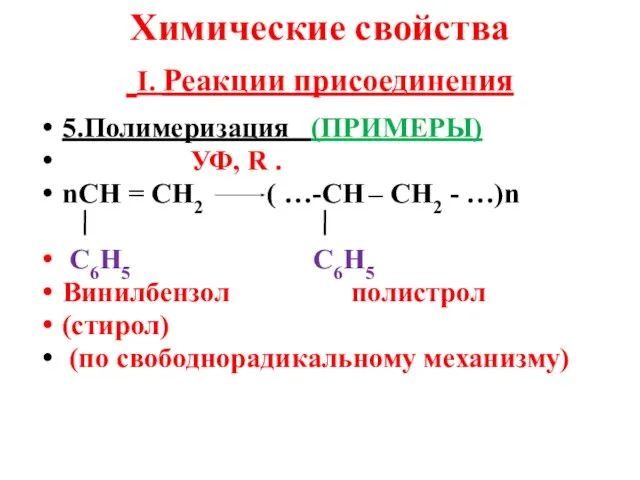
- 12. Химические свойства I. Реакции присоединения 5.Полимеризация (ПРИМЕРЫ) УФ, R . nСН = СН2 ( …-СН –
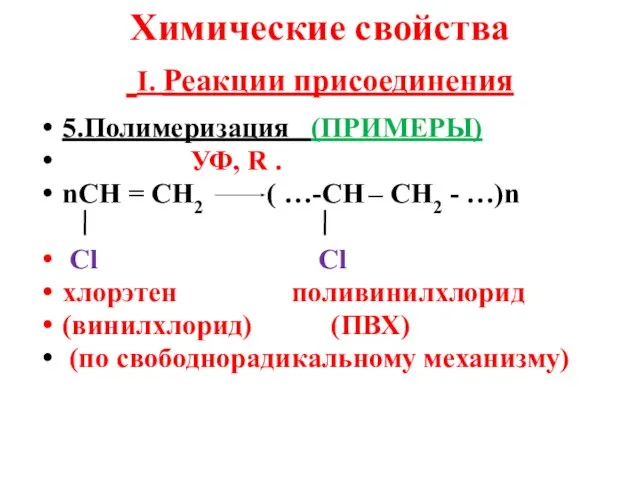
- 13. Химические свойства I. Реакции присоединения 5.Полимеризация (ПРИМЕРЫ) УФ, R . nСН = СН2 ( …-СН –
- 14. Химические свойства I. Реакции присоединения 5.Полимеризация (ПРИМЕРЫ) УФ, R . nСН = СН2 ( …-СН –
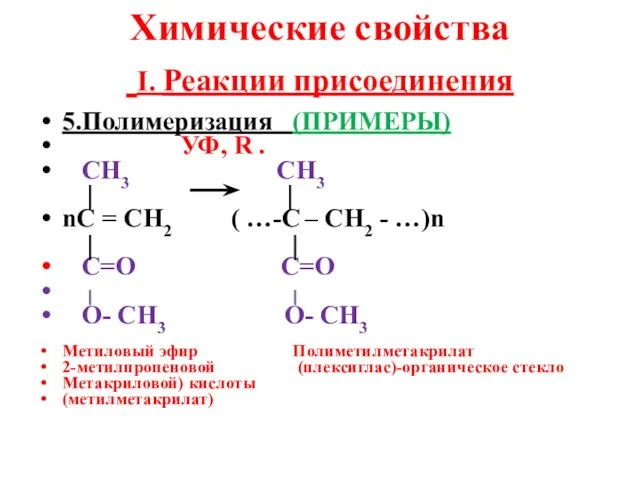
- 15. Химические свойства I. Реакции присоединения 5.Полимеризация (ПРИМЕРЫ) УФ, R . СН3 СН3 nС = СН2 (
- 16. Химические свойства II. Реакции окисления Горение (полное разрушение углеродной цепи) СН2 = СН2 + 3О2 2СО2
- 17. Химические свойства II. Реакции окисления Мягкое окисление (с сохранением углеродной цепи) СН2 = СН2 + [О]
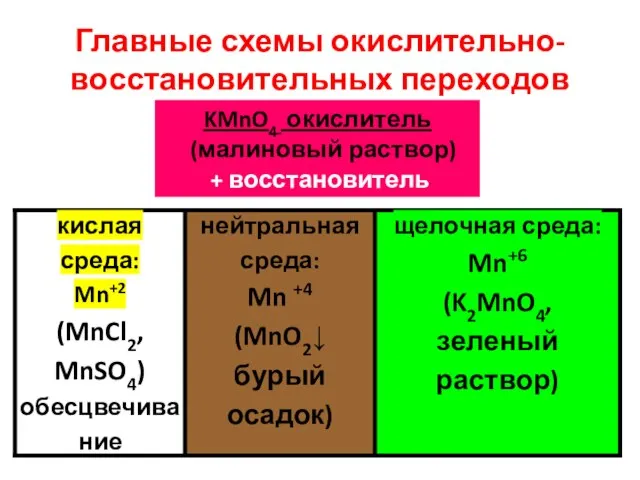
- 18. Главные схемы окислительно-восстановительных переходов KMnO4 окислитель (малиновый раствор) + восстановитель
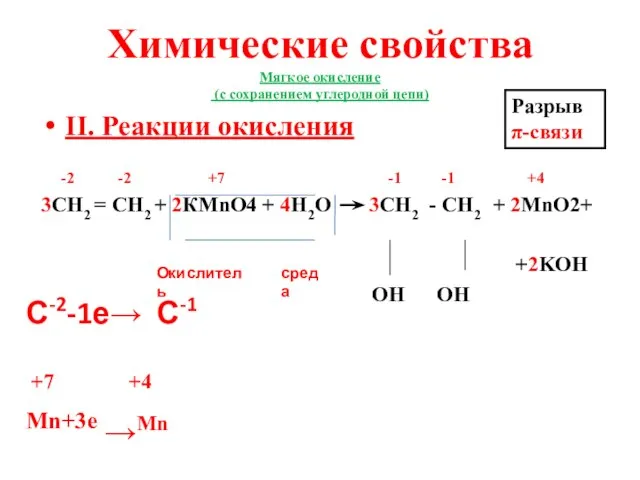
- 19. Химические свойства Мягкое окисление (с сохранением углеродной цепи) II. Реакции окисления -2 -2 +7 -1 -1
- 20. Химические свойства II. Реакции окисления Глубокое окисление (с расщеплением углеродной цепи) [О] СН3- СН= СН-СН3 2СН3СООН
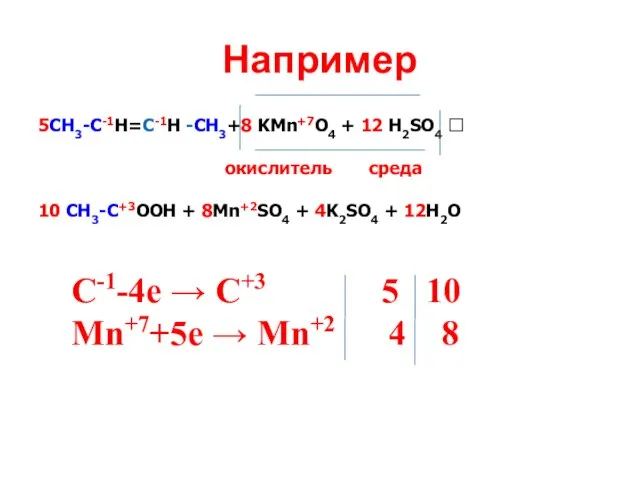
- 21. Например 5СН3-С-1Н=С-1Н -СН3+8 KMn+7O4 + 12 H2SO4 ? окислитель среда 10 CH3-C+3OOH + 8Mn+2SO4 + 4K2SO4
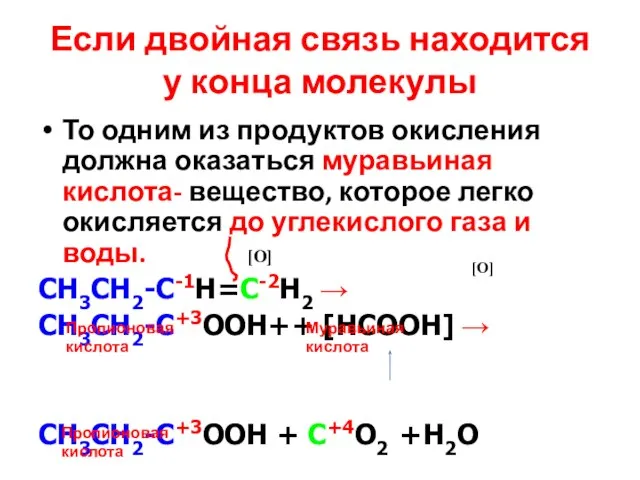
- 22. Если двойная связь находится у конца молекулы То одним из продуктов окисления должна оказаться муравьиная кислота-
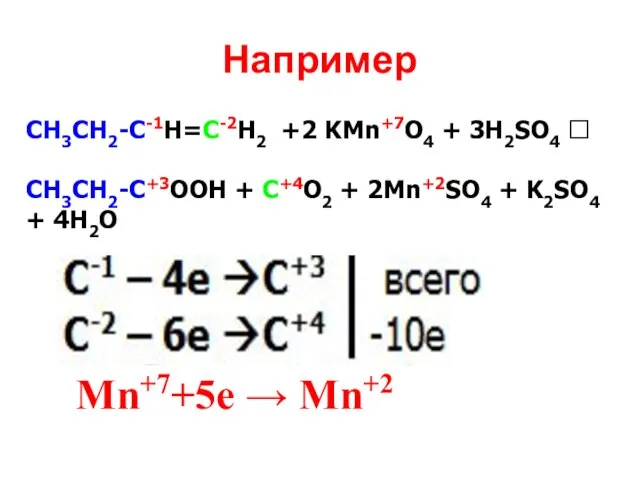
- 23. Например СН3СН2-С-1Н=С-2Н2 +2 KMn+7O4 + 3H2SO4 ? CH3СН2-C+3OOH + C+4O2 + 2Mn+2SO4 + K2SO4 + 4H2O
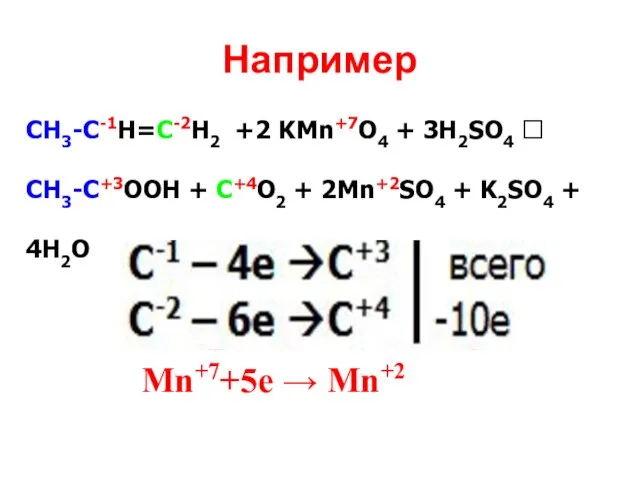
- 24. Например СН3-С-1Н=С-2Н2 +2 KMn+7O4 + 3H2SO4 ? CH3-C+3OOH + C+4O2 + 2Mn+2SO4 + K2SO4 + 4H2O
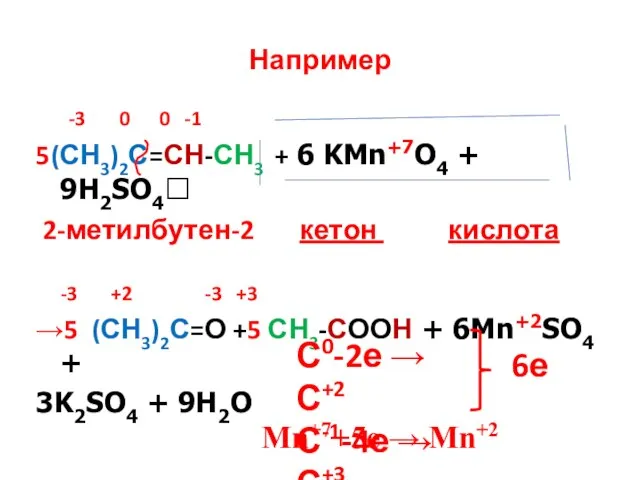
- 25. Если в молекуле алкена атом углерода при двойной связи содержит два углеродных заместителя (например: 2-метилбутен-2) то
- 26. Например -3 0 0 -1 5(СН3)2С=СН-СН3 + 6 KMn+7O4 + 9H2SO4? 2-метилбутен-2 кетон кислота -3 +2
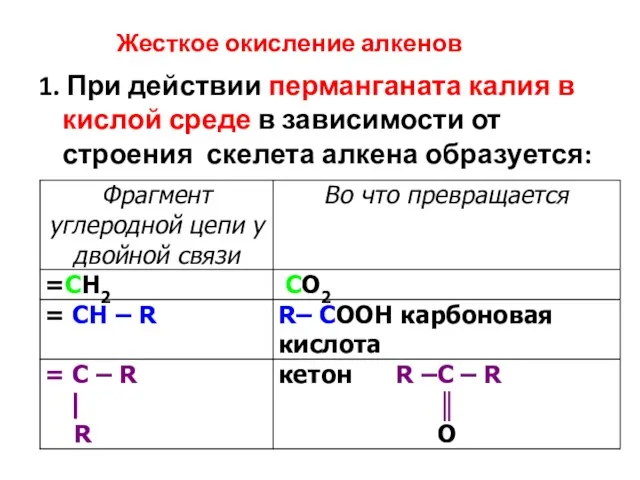
- 27. 1. При действии перманганата калия в кислой среде в зависимости от строения скелета алкена образуется: Жесткое
- 28. ОВР с участием органических соединений Окисление алкенов в нейтральной среде: C2H4 + 2KMnO4 + 2H2O→ CH2OH–CH2OH
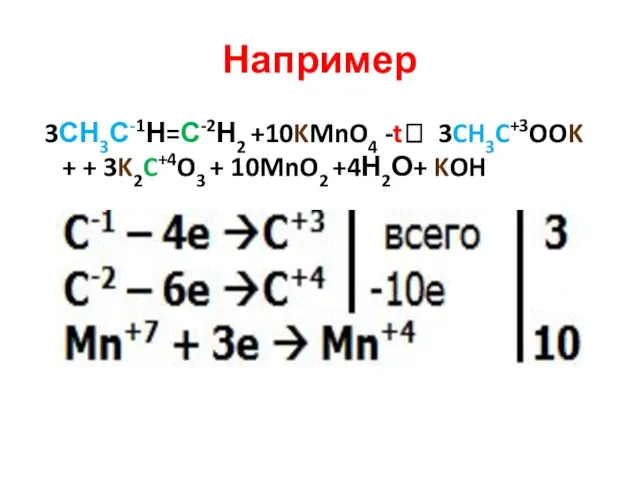
- 29. 2. Если реакция протекает в нейтральной среде ПРИ нагревании, то соответственно получаются калиевые соли:
- 30. Например 3СН3С-1Н=С-2Н2 +10KMnO4 -t? 3CH3C+3OOK + + 3K2C+4O3 + 10MnO2 +4Н2О+ KOH
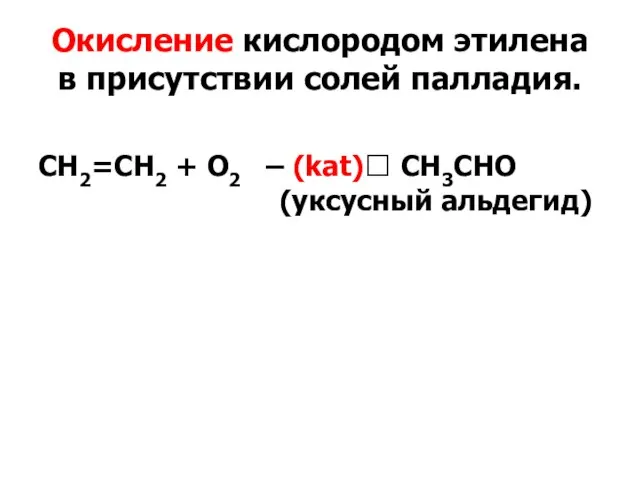
- 31. Окисление кислородом этилена в присутствии солей палладия. СН2=СН2 + O2 – (kat)? CН3СНО (уксусный альдегид)
- 32. Хлорирование и бромирование в боковую цепь: если реакция с хлором проводится на свету или при высокой
- 33. Химические свойства алкенов Для алкенов характерны: реакции присоединения к двойной связи, реакции окисления, реакции замещения в
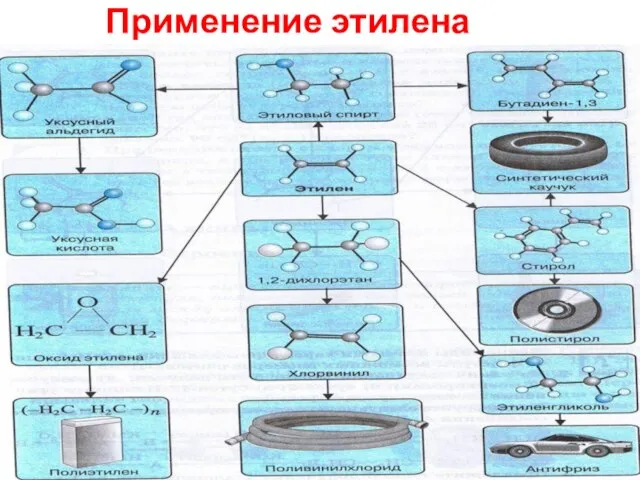
- 34. Применение этилена
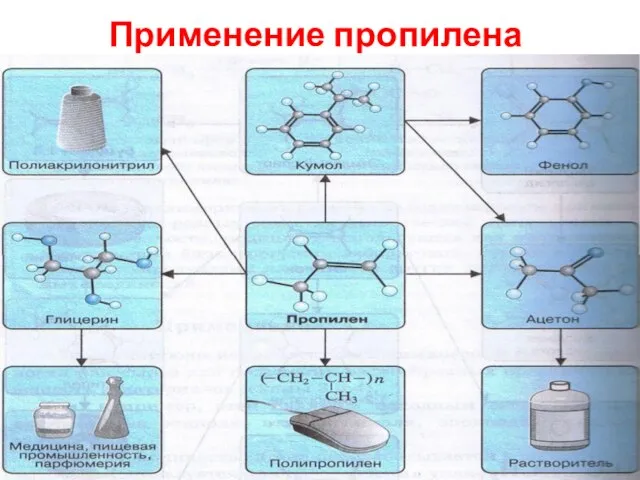
- 35. Применение пропилена СН2 = СН2
- 37. Скачать презентацию










![Химические свойства II. Реакции окисления Глубокое окисление (с расщеплением углеродной цепи) [О]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/851799/slide-19.jpg)





 Реакции в органической химии
Реакции в органической химии Презентация на тему Кристаллические решетки 9 класс
Презентация на тему Кристаллические решетки 9 класс  Явления, смеси и способы их разделения
Явления, смеси и способы их разделения Лекция_классы_неогранических_соединений
Лекция_классы_неогранических_соединений Металлы
Металлы Физические и химические явления
Физические и химические явления Методы выделения и разделения радионуклидов
Методы выделения и разделения радионуклидов Арены. Бензол
Арены. Бензол Основные классы неорганических веществ
Основные классы неорганических веществ Презентация на тему Щелочноземельные металлы
Презентация на тему Щелочноземельные металлы  Теоретические основы органической химии. Лекция 25
Теоретические основы органической химии. Лекция 25 Степень окисления
Степень окисления Получение металлов в промышленности. Чёрная металлургия
Получение металлов в промышленности. Чёрная металлургия Силикатная промышленность и её продукция
Силикатная промышленность и её продукция Химическая технология органических веществ
Химическая технология органических веществ Дорогие и дешёвые лекарства: Чем похожи и чем отличаются друг от друга?
Дорогие и дешёвые лекарства: Чем похожи и чем отличаются друг от друга? валентность (1)
валентность (1) Электролиз и его применение
Электролиз и его применение Лавка возможностей
Лавка возможностей Презентация на тему Твердые вещества
Презентация на тему Твердые вещества  Стекло. Технология изготовления стекла
Стекло. Технология изготовления стекла Физико-химическая механика и реология дисперсных структур. Лекция 15
Физико-химическая механика и реология дисперсных структур. Лекция 15 Природный газ
Природный газ Урок по химии в 10 классе на тему: «Жиры» 2008 год.
Урок по химии в 10 классе на тему: «Жиры» 2008 год. Вещество. Простые и сложные вещества
Вещество. Простые и сложные вещества Коррозия металла
Коррозия металла Алкены. Решение задач и упражнений
Алкены. Решение задач и упражнений Анализ свойств карбамидоформальдегидных смол
Анализ свойств карбамидоформальдегидных смол