Содержание
- 2. КАФЕДРА физиологии и ХИМИИ
- 3. ЛЕКЦИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ С ЭЛЕКТРОННОЙ ТОЧКИ ЗРЕНИЯ
- 4. ТИПЫ РЕАКЦИЙ: 1. РЕАКЦИИ, ПРОТЕКАЮЩИЕ БЕЗ ИЗМЕНЕНИЯ СТЕПЕНИ ОКИСЛЕНИЯ: 2+ 4+ 2- 2+ 2- 4+ 2-
- 5. 2. РЕАКЦИИ, ПРОТЕКАЮЩИЕ С ИЗМЕНЕНИЕМ СТЕПЕНИ ОКИСЛЕНИЯ АТОМОВ РЕАГИРУЮЩИХ ВЕЩЕСТВ: ТИПЫ РЕАКЦИЙ: 2+ 2- 0 0
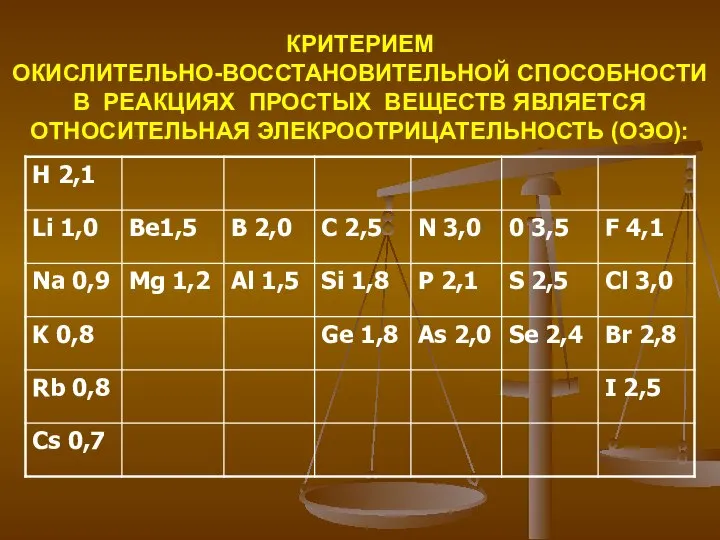
- 6. КРИТЕРИЕМ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ СПОСОБНОСТИ В РЕАКЦИЯХ ПРОСТЫХ ВЕЩЕСТВ ЯВЛЯЕТСЯ ОТНОСИТЕЛЬНАЯ ЭЛЕКРООТРИЦАТЕЛЬНОСТЬ (ОЭО):
- 7. ЧЕМ БОЛЬШЕ ЗНАЧЕНИЕ ОЭО, ТЕМ СИЛНЕЕ ВЫРАЖЕНЫ ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА ЭЛЕМЕНТА, И НАООБОРОТ
- 8. НАПРАВЛЕНИЕ ПЕРЕХОДА ЭЛЕКТРОНОВ В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЯХ ПРОСТЫХ ВЕЩЕСТВ: Mg ОЭО = 1,23 Cl ОЭО = 2,83
- 9. 0 0 2Na + H2 = 0 1+ В-тель Na – ē → Na процесс ок-ния
- 10. СЛОЖНЫЕ ВЕЩЕСТВА, ПРОЯВЛЯЮЩИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА: 1 ГРУППА: ТИПИЧНЫЕ ОКИСЛИТЕЛИ ( MAX. СТЕПЕНЬ ОКИСЛЕНИЯ) 6+ 7+ 7+
- 11. 3 ГРУППА: ОКИСЛИТЕЛИ-ВОССТАНОВИТЕЛИ (ПРОМЕЖУТОЧНАЯ СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ) СЛОЖНЫЕ ВЕЩЕСТВА, ПРОЯВЛЯЮЩИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА: 4+ 4+ 4+ 3+
- 12. УРАВНЕНИЕ НЕРНСТА (1888 г.) E = Eо+ R T nF ln а ок-ля а в-ля ,
- 13. n – ЗАРЯД ИОНА МЕТАЛЛА F – ЧИСЛО ФАРАДЕЯ = 96500 КУЛ / Г-ЭКВ R –
- 14. НАПРАВЛЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ: E0 Sn+4/ Sn+2 Fe+3/ Fe+2 СЛЕДОВАТЕЛЬНО: E 0 > E 0 Sn+4/ Sn+2
- 15. +3 +2 +2 +4 2FeCl3 + SnCl2 → 2FeCl2 + SnCl4 +3 +2 Ок-тель Fe +
- 16. КЛАССИФИКАЦИЯ РЕАКЦИЙ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ: 1. МЕЖМОЛЕКУЛЯРНЫЕ РЕАКЦИИ: +4 0 +6 -2 2SO2 + O2 = 2SO3 +4
- 17. 2. ВНУТРИМОЛЕКУЛЯРНЫЕ РЕАКЦИИ: КЛАССИФИКАЦИЯ РЕАКЦИЙ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ: +5 -2 t° -1 0 2KClO3 → 2KCl + 3O2
- 18. КЛАССИФИКАЦИЯ РЕАКЦИЙ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ: 3. РЕАКЦИИ ДИСПРОПОРЦИОНИРОВАНИЯ: +4 t° -2 +6 4 Na2SO3 → Na2S + 3Na2SO4
- 19. ПОДБОР КОЭФФИЦИЕНТОВ В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЯХ
- 20. +7 +4 2KMnO4+5Na2SO3+3H2SO4→ +2 +6 K2SO4+2MnSO4+5Na2SO4+3H20 А) МЕТОД ЭЛЕКТРОННОГО БАЛАНСА СХЕМА ЭЛЕКТРОННОГО БАЛАНСА: +7 +2 Ок-тель
- 21. +7 +4 2KMnO4+5Na2SO3+3H2SO4→ +2 +6 K2SO4+2MnSO4+5Na2SO4+3H20 Б) МЕТОД ИОННОГО БАЛАНСА (ПОЛУРЕАКЦИЙ) СХЕМА ИОННОГО БАЛАНСА (СРЕДА КИСЛАЯ):
- 22. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ РЕАКЦИЯ В ЩЕЛОЧНОЙ СРЕДЕ 2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
- 23. В НЕЙТРАЛЬНОЙ СРЕДЕ: 2KMnO4 + 3Na2SO3 + H2O → 2MnO2↓ + 3Na2SO4 + 2KOH – 0
- 24. ВЛИЯНИЕ СРЕДЫ НА СТЕПЕНЬ ВОССТАНОВЛЕНИЯ MnO4– МАЛИНОВЫЙ БЕСЦВЕТНЫЙ ЗЕЛЕНЫЙ КОРИЧНЕВЫЙ
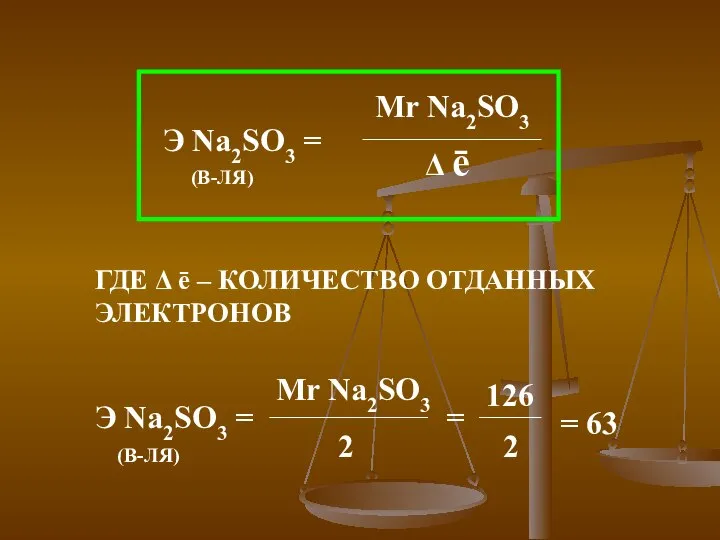
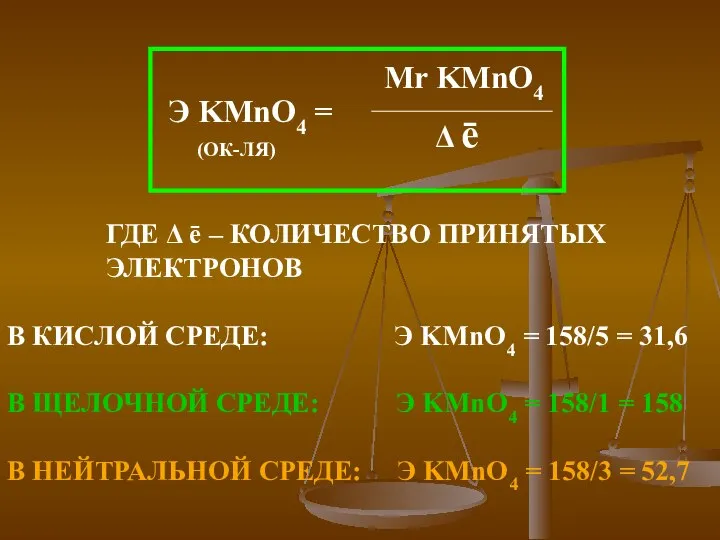
- 25. ГДЕ Δ ē – КОЛИЧЕСТВО ОТДАННЫХ ЭЛЕКТРОНОВ =
- 26. В КИСЛОЙ СРЕДЕ: Э KMnO4 = 158/5 = 31,6 В ЩЕЛОЧНОЙ СРЕДЕ: Э KMnO4 = 158/1
- 28. Скачать презентацию






















 Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов
Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов Основные особенности процессов растворения твёрдых веществ
Основные особенности процессов растворения твёрдых веществ Ароматические вещества и их значение для человека
Ароматические вещества и их значение для человека Практика по химии
Практика по химии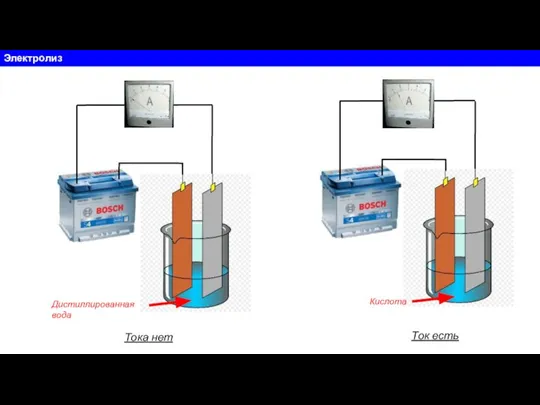 Электролиз. Электролитическая диссоциация
Электролиз. Электролитическая диссоциация Степени окисления химических элементов в соединениях
Степени окисления химических элементов в соединениях Уравнения диссоциации
Уравнения диссоциации Основные сведения о строении атома. Состав атомных ядер
Основные сведения о строении атома. Состав атомных ядер Валентность (7 класс)
Валентность (7 класс) Классификация органических реакций, реагентов
Классификация органических реакций, реагентов Незаменимая уксусная кислота
Незаменимая уксусная кислота Валентность. Валентные возможности атомов
Валентность. Валентные возможности атомов Классы неорганических веществ
Классы неорганических веществ Критерии оценки качества природного газа
Критерии оценки качества природного газа Иерархия классов методов моделирования. Атомистические и микроскопические методы
Иерархия классов методов моделирования. Атомистические и микроскопические методы Распределение электронов в атомах
Распределение электронов в атомах Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Простые вещества – металлы. Общие физические свойства металлов
Простые вещества – металлы. Общие физические свойства металлов Substanță chimică
Substanță chimică Методы разделения и очистки веществ
Методы разделения и очистки веществ Альдегиды
Альдегиды Тема: «Первоначальные сведения о строении вещества»
Тема: «Первоначальные сведения о строении вещества» Генетические ряды углеводородов. Обобщение и систематизация знаний
Генетические ряды углеводородов. Обобщение и систематизация знаний Свободные атомы. Простые вещества. Сложные вещества
Свободные атомы. Простые вещества. Сложные вещества Аммиак NH3
Аммиак NH3 Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Жиры – биологически важные органические соединения
Жиры – биологически важные органические соединения Удельная теплота сгорания
Удельная теплота сгорания