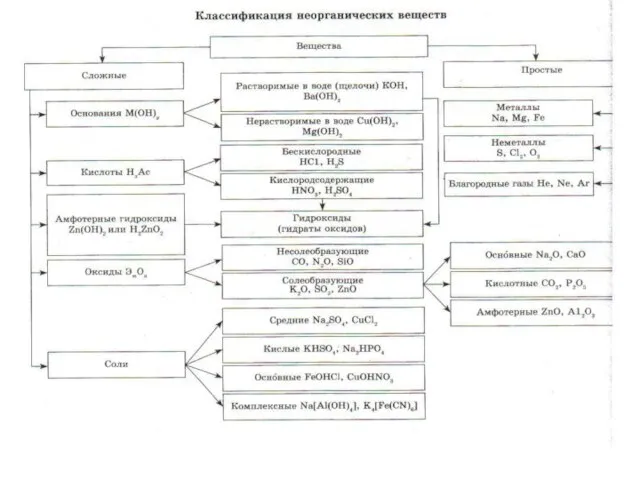
Слайд 3ОКСИДЫ
Оксиды- бинарные соединения с кислородом в степени окисления (-2).
Общая формула оксидов: ЭmOn

где m число атомов элемента Э, а
n – число атомов кислорода.
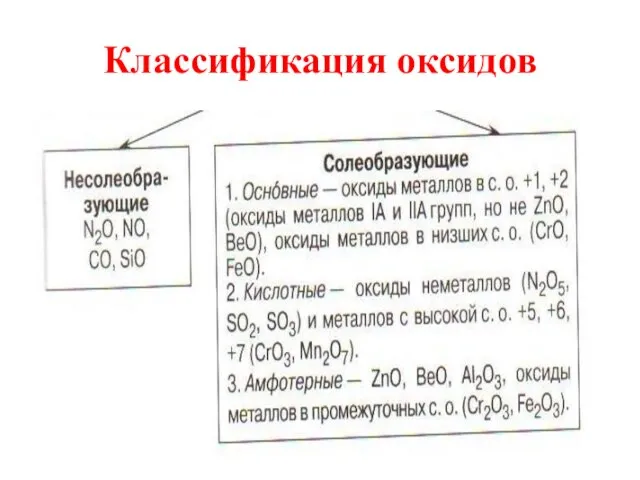
Слайд 5Несолеобразующие оксиды
Несолеебразующими называются такие оксиды, которые не взаимодействуют ни со щелочами, ни

с кислотами и не образуют солей. Их немного, в их состав входят неметаллы.
Слайд 6Солеобразующие
Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют

при этом соль и воду.
Среди солеобразующих оксидов различают оксиды: основные, кислотные, амфотерные.
Слайд 7Основные оксиды
Основные оксиды - это такие оксиды, которым соответствуют основания. Например:

СаО - Са(ОН)2
Na2O - NaOH
Слайд 8Кислотные оксиды
Кислотные оксиды - это такие оксиды, которым соответствуют кислоты.
Это оксиды неметаллов:

N2O 5 соответствует Н NO 3 ,
SO3 – H2SO4
А так же оксиды металлов с большим значением степеней окисления:
Сr2 O3 - H2 Сr O4
Mn2O7 - H MnO4
Слайд 9Амфотерные оксиды
Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или

кислотные свойства.
Это ZnO, Al2O3, Cr2O3, V2O3
Амфотерные оксиды с водой непосредственно не соединяются.






 Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Применение алкенов
Применение алкенов Цикл фосфора (окончание). Цикл в реках и в море
Цикл фосфора (окончание). Цикл в реках и в море Предельные углеводороды Алканы
Предельные углеводороды Алканы Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи
Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Презентация на тему Теория А. М. Бутлерова
Презентация на тему Теория А. М. Бутлерова  Стехиометрические законы химии
Стехиометрические законы химии Химия элементов неметаллов. Сера
Химия элементов неметаллов. Сера Строение атома. Планетарная модель атома Резерфорда
Строение атома. Планетарная модель атома Резерфорда Минералы
Минералы Геометрия молекул
Геометрия молекул Предмет химии. Вещества
Предмет химии. Вещества Круговорот серы в природе
Круговорот серы в природе Физичекие явления - основа разделения смесей в химии. 17.09.21
Физичекие явления - основа разделения смесей в химии. 17.09.21 Углеродные материалы. Основные понятия и определения. Области их применения
Углеродные материалы. Основные понятия и определения. Области их применения Презентация на тему Химия и стирка
Презентация на тему Химия и стирка  Железо и его соединения
Железо и его соединения Спирты и фенолы
Спирты и фенолы Решение задач
Решение задач Физические явления. Способы разделения смесей
Физические явления. Способы разделения смесей Разбор контрольной работы. Химия (9 класс)
Разбор контрольной работы. Химия (9 класс) Презентация на тему Важнейшие классы неорганических соединений
Презентация на тему Важнейшие классы неорганических соединений  Коррозия металлов. Лекция №8
Коррозия металлов. Лекция №8 Арены. Бензол
Арены. Бензол Химические элементы. Викторина
Химические элементы. Викторина Салқындатқыш агенттер және оларды салқындату әдістері
Салқындатқыш агенттер және оларды салқындату әдістері Буферные системы
Буферные системы