Содержание
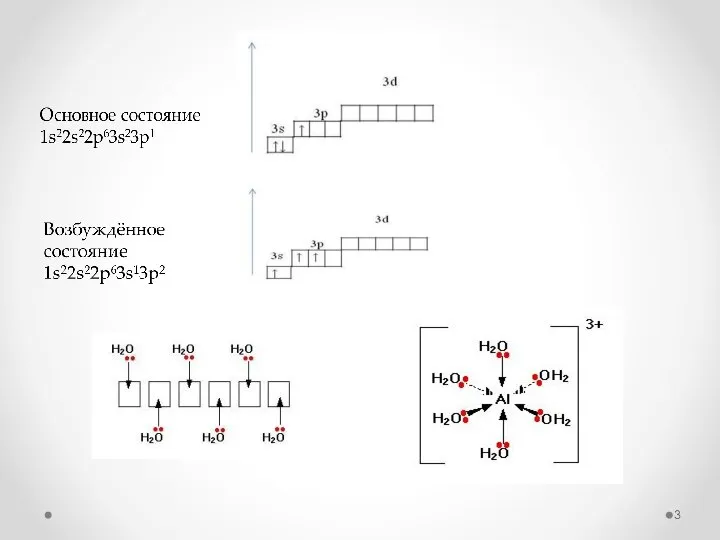
- 2. Алюми́ний (Al, лат. aluminium) – переходной металл, наиболее распространённый и третий по распространённости химический элемент в
- 4. АЛЮМИНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ RnАlХ3-n где R-органический радикал; Х-Hal, H, OR, SR, NR2, RCOO, CN и др.; n
- 5. Способы получения Прямой синтез (метод Карла Циглера). Взаимодействием олефинов с Al и H 6 СН2 =
- 6. 5) Взаимодействие полнозамещенных алюминийорганических соединений с AlX3 (C2H5)3Al + 2 AlCl3 → 3C2H5AlCl2 Способы получения 6)
- 7. Свойства 1) R3Al + 3 H2O → 3 RH + Al(OH)3 R3Al + n R`OH →
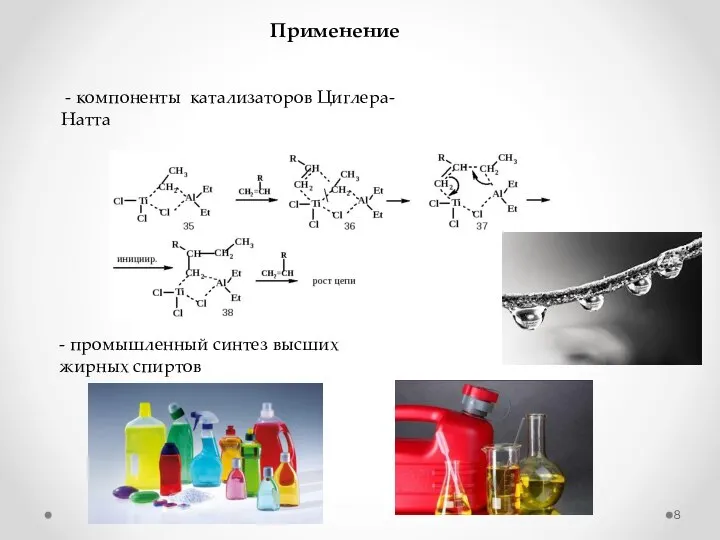
- 8. Применение - компоненты катализаторов Циглера-Натта - промышленный синтез высших жирных спиртов
- 9. Алюминийорганический синтез спиртов складывается из трех последовательных стадий: Синтез жирных спиртов 1. Полимеризация этилена с триэтилалюминием
- 10. 2. Окисление высших алюминийтриалкилов при 20 – 100 оС Синтез жирных спиртов 3. Гидролиз алкоголятов алюминия
- 12. Скачать презентацию







 Нуклеиновые кислоты
Нуклеиновые кислоты 10 класс природные источники углеводородов
10 класс природные источники углеводородов Нефть: история и ее применение
Нефть: история и ее применение Газовые законы
Газовые законы Карбонат натрия
Карбонат натрия Электролитическая диссоциация
Электролитическая диссоциация Валентность. Определение валентности по формулам
Валентность. Определение валентности по формулам Химия в быту
Химия в быту Электродные процессы. Электроды. Потенциометрия
Электродные процессы. Электроды. Потенциометрия Строение и химический состав костей, рост костей
Строение и химический состав костей, рост костей Подготовка к ГИА 2021
Подготовка к ГИА 2021 Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Расчет по химическим уравнениям
Расчет по химическим уравнениям Вещество как система. Номенклатура неорганических веществ
Вещество как система. Номенклатура неорганических веществ Структура периодической таблицы
Структура периодической таблицы Удельная теплота сгорания
Удельная теплота сгорания Сложные эфиры
Сложные эфиры Органическая химия. Химические свойства и типы реакций. (9 класс)
Органическая химия. Химические свойства и типы реакций. (9 класс) Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов
Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов Графит. 9 класс
Графит. 9 класс Углерод и наше здоровье
Углерод и наше здоровье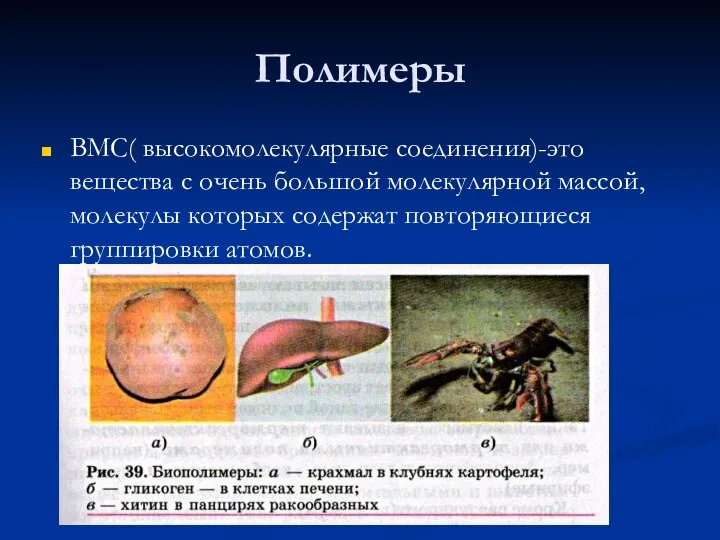 Полимеры
Полимеры Презентация по Химии "Химические элементы металлы и здоровье человека"
Презентация по Химии "Химические элементы металлы и здоровье человека"  Комплексные соединения
Комплексные соединения Термокаталитические процессы переработки нефтяных фракций
Термокаталитические процессы переработки нефтяных фракций Эфиры. 10 класс
Эфиры. 10 класс Водорастворимые витамины. 7 свойств водорастворимых витаминов
Водорастворимые витамины. 7 свойств водорастворимых витаминов Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1