Слайд 2Металічні елементи в Періодичній системі:
• — s-елементи, • — d-елементи, •
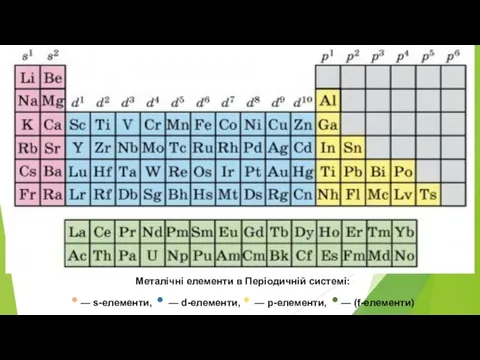
— р-елементи, • — (f-елементи)
Слайд 3Для металічних елементів характерна невелика електронегативність — менша за 1,8. Найбільше металічні

властивості виявлені в елементів ІА групи Періодичної системи — лужних елементів. їхні атоми настільки легко віддають валентні електрони, що в природі ці елементи перебувають виключно у вигляді сполук.
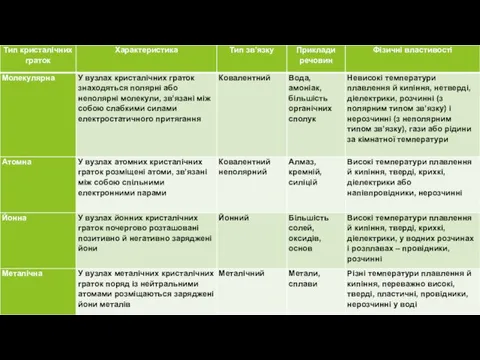
Слайд 5Метали лише в газоподібному стані існують у вигляді атомів. У твердому чи

рідкому агрегатному стані метали складаються з катіонів та спільних (належать відразу багатьом атомам) електронів. Особливість такої будови простих речовин металів зумовлена наявністю металічного зв’язку.
Металічний зв’язок
Слайд 61. Загальна характе-ристика хімічного елемента

Слайд 72. Поширеність у природі
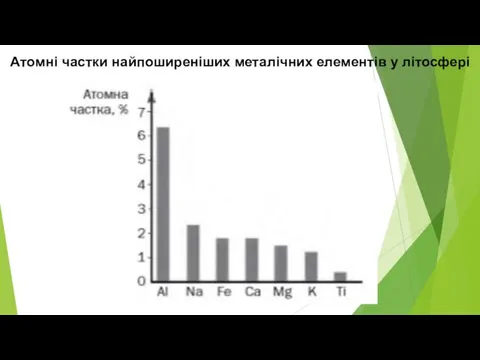
Алюміній є найпоширенішим металічним елементом на Землі.
Його вміст

у земній корі становить 8% (за масою) — це перше місце серед металічних елементів і третє серед усіх елементів.
Через високу хімічну активність у вигляді простої речовини Алюміній у природі не трапляється. Він міститься у складі багатьох сполук, які утворюють ґрунти,— глиноземів (Аl2O3) і бокситів (Аl2O3хН2O).
Також Алюміній є у складі багатьох мінералів, зокрема коштовного каміння. Різне забарвлення цих мінералів зумовлене невеликими домішками оксидів певних металічних елементів (у рубінів — Сr, у сапфірів — Ті та Fe тощо).
Незважаючи на поширеність у природі, Алюміній не міститься в живих організмах і не бере участі в метаболізмі.
В Україні є великі поклади алюмінієвої руди у вигляді бокситів і глинозему в Приазов’ї, на Закарпатті та в межах Українського кристалічного щита — тектонічної смуги, яка простягається вздовж середньої течії Дніпра на відстань понад 1000 км і завширшки 250 км.
Алюмінієва руда боксит
Слайд 8Атомні частки найпоширеніших металічних елементів у літосфері
Слайд 9Природні сполуки алюмінію: а — каолін; б — корунд; в — боксит.
Алюмінієвмісні

мінерали: а – берил, б – аквамарин, в – рубін, г – сапфір, д – смарагд, е – корунд, є – топаз.
Слайд 103. Будова атома Алюмінію
На зовнішньому енергетичному рівні атома Алюмінію перебувають три електрони:
Атом

легко їх втрачає, перетворюючись на тризарядний катіон:
Катіони Алюмінію є складниками більшості сполук елемента.
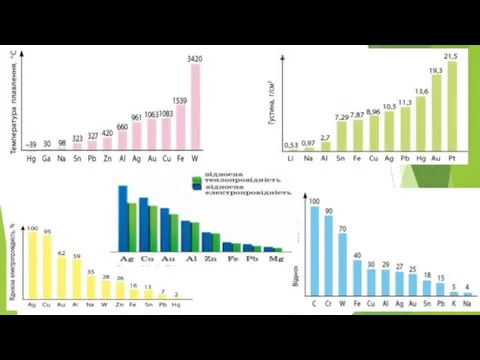
Слайд 114. Фізичні властивості алюмінію
• Алюміній — парамагнітний сріблясто-білий метал;
• ковкий, легко

витягується в дріт, добре піддається формовці й утворює фольгу;
• tпл. = 660°С, tкип. = 2520 °С;
• належить до групи легких металів, густина 2,7 г/см3;
• виявляє високу тепло- й електропровідність (65 % від електропровідності міді), а також високу світловідбивну здатність.
Алюмінієва фольга (1), профіль (2) та заготовки (3).
Слайд 135. Хімічні властивості алюмінію
Алюміній — дуже активний метал, у ряду активності він

розміщений значно лівіше від водню. Але поверхня алюмінію вкрита алюміній оксидом — міцною й тугоплавкою речовиною (tпл. = 2044 °С), унаслідок чого алюміній за звичайних умов не взаємодіє з киснем повітря та водою.
1. Взаємодія з киснем.
Алюміній активно взаємодіє з киснем повітря, але реакція відбувається лише на зрізі зразка. Якщо зруйнувати плівку алюміній оксиду на поверхні металу або попередити її утворення нанесенням на поверхню алюмінієвого виробу шару ртуті (амальгами алюмінію), то алюміній досить швидко перетворюється на оксид:
Видовище горіння алюмінієвої пудри, розпорошеної в полум’ї пальника, захоплює
Слайд 152. Взаємодія з іншими неметалами.
Порошкоподібний алюміній активно взаємодіє з галогенами за

звичайних умов, а із сіркою, фосфором та іншими неметалами — за нагрівання. Наприклад, із йодом реакція відбувається за кімнатної температури, але за наявності каталітичної кількості води:
Під час взаємодії алюмінію з йодом виділяється велика
кількість теплоти, під дією якої йод частково сублімує,
утворюючи хмару випарів йоду фіолетового кольору.
Алюміній реагує з галогенами - фтором, хлором, бромом, йодом. Унаслідок реакцій утворюються відповідні галогеніди Алюмінію:
Слайд 16Горіння алюмінію в хлорі супроводжується виділенням теплової та світлової енергії. Після закінчення

реакції колбу заповнює дим - розпорошений алюміній хлорид.
Так само бурхливо відбувається реакція алюмінію з бромом.
Реакція алюмінію з йодом каталітична. Аби вона почалася, достатньо добавити кілька крапель води до суміші алюмінієвого порошку з йодом.
Взаємодія алюмінію з галогенами - хлором (1), бромом (2), йодом (3)
Слайд 183. Взаємодія з кислотами.
Як і всі активні метали, алюміній витісняє водень

із розбавлених розчинів кислот:
За нагрівання алюміній взаємодіє з концентрованими кислотами-окисниками (холодна нітратна кислота пасивує алюміній):
Слайд 215. Відновлення металів (алюмотермія).
Алюміній — активний метал, тому витісняє інші метали

з їхніх сполук, зокрема з оксидів. Ці реакції використовують для одержання деяких металів алюмотермічним способом:
Гранули алюмінію до і після реакції з купрум(ІІ) хлоридом
Слайд 226. Застосування алюмінію
• У великих кількостях алюміній використовують у металургії для одержання

інших менш активних металів методом алюмотермії.
• Алюміній є цінним конструкційним матеріалом. Він відносно легкий (густина алюмінію набагато менша за густину сталі), але досить міцний. Тому з алюмінію виготовляють легкі й довговічні будівельні конструкції
• Багато алюмінію потребує авіаційна промисловість. Дюралюмінієм обшивають корпуси літаків.
• Пилоподібний алюміній та деякі його сполуки використовують як тверде ракетне пальне. • Алюміній легко піддається штамповці, він стійкий до корозії, а його сполуки нетоксичні. Завдяки цьому з алюмінію виготовляють столові прибори, посуд, бляшанки, кухонні гаджети.
• Через свою високу відбивну здатність та легкість напилення алюміній є ідеальним матеріалом для виготовлення дзеркал.
• Суміш алюмінію з ферум(ІІІ) оксидом — терміт — використовують для зварювання залізничних рейок та труб.
Застосування алюмінію:
а — у будівництві;
б — в авіаційній промисловості;
в — для виготовлення харчових ємностей
Слайд 241. Схарактеризуйте хімічну активність алюмінію.
2. Чим ви поясните, що Алюміній має

ступінь окиснення +3, а не, приміром, +2 чи -5?
3. Зважаючи на хімічні властивості алюмінію, сформулюйте поради щодо використання алюмінієвого кухонного посуду.
4. Де в промисловості застосовують відновні властивості алюмінію?
5. Схарактеризуйте хімічний елемент Алюміній та фізичні властивості утвореної ним простої речовини.
6. Чому не можна тримати луги в алюмінієвій тарі?
7. Користуючись рядом активності металів, розташуйте метали мідь, натрій, алюміній за зростанням хімічної активності.
8. Напишіть хімічні рівняння за схемою перетворень:
9. Сплав міді й алюмінію масою 15 г обробили надлишком хлоридної кислоти й добули водень об’ємом 13,44 л (н. у.). Обчисліть масові частки металів у сплаві.
Слайд 2510. На початку XX ст. взаємодією алюмінію з розчином лугу добували водень,

яким заповнювали дирижаблі. Обчисліть відносний вихід водню об’ємом 295,68 л (н. у.), для добування якого було взято алюміній масою 270 г.
11. Допишіть схеми реакцій і перетворіть їх на хімічні рівняння:
12. Знайдіть масову частку алюміній оксиду в мінералі беміті АІО(ОН).
13. Наведіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
14. Обчисліть масу Алюмінію в 48,3 г кристалогідрату АІСІ3 • 6Н2О.
15. У якому об’ємі води потрібно розчинити 7,5 г кристалогідрату AI(NО3)3 • 9Н2О, щоб приготувати розчин із масовою часткою безводної солі 7,1 %?






















 Химическое равновесие. Задачи
Химическое равновесие. Задачи Алканы
Алканы Автомобильные бензины. Свойства топлив
Автомобильные бензины. Свойства топлив Пиримидин. Пиримидиновые основания
Пиримидин. Пиримидиновые основания Возможности модернизации совместного производства фенола и ацетона кумольным способом
Возможности модернизации совместного производства фенола и ацетона кумольным способом Строение и свойства металлов
Строение и свойства металлов Презентация на тему Соединения серы
Презентация на тему Соединения серы  10_KISLOTNO_OSNOVNOE_TITROVANIE
10_KISLOTNO_OSNOVNOE_TITROVANIE Природные источники углеводородов. Природный и попутный нефтяные газы. Нефть. Каменный уголь
Природные источники углеводородов. Природный и попутный нефтяные газы. Нефть. Каменный уголь Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Игра Что? Где? Когда?. Химия
Игра Что? Где? Когда?. Химия Диссоциация веществ
Диссоциация веществ Квантовая химия
Квантовая химия Классификация нефтей. Основы переработки нефти и нефтепродуктов
Классификация нефтей. Основы переработки нефти и нефтепродуктов Основные понятия химической термодинамики
Основные понятия химической термодинамики Уровень С1 в ГИА
Уровень С1 в ГИА Производство препарата Салициловая кислота, раствор для наружного применения спиртовой 2-х процентный
Производство препарата Салициловая кислота, раствор для наружного применения спиртовой 2-х процентный Энергетика химических реакций
Энергетика химических реакций Изучение пенопласта
Изучение пенопласта Презентация на тему Соли угольной кислоты
Презентация на тему Соли угольной кислоты  Степень окисления
Степень окисления Кислород
Кислород Сера
Сера Полимеры. Функции полимеров
Полимеры. Функции полимеров Электролиз расплавов и растворов солей
Электролиз расплавов и растворов солей Простые вещества – неметаллы. Аллотропия
Простые вещества – неметаллы. Аллотропия Изомерия. Виды изомерии
Изомерия. Виды изомерии Презентация на тему Щелочные металлы
Презентация на тему Щелочные металлы