Содержание
- 2. Основание-сложное вещество, состоящее из катиона металла и связанных с ним одной или нескольких гидроксогрупп. О Н
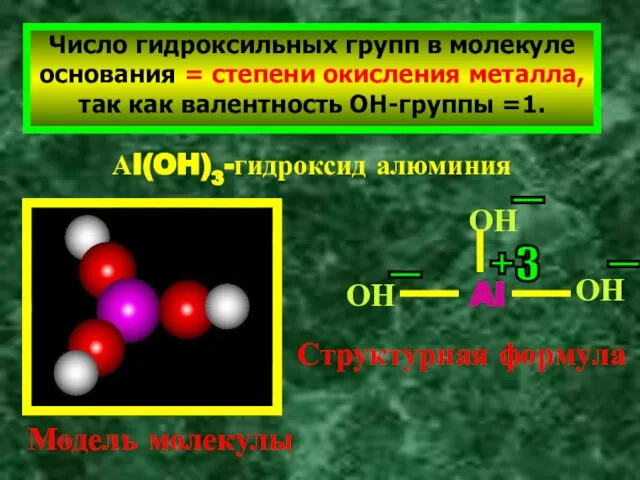
- 3. Число гидроксильных групп в молекуле основания = степени окисления металла, так как валентность ОН-группы =1. Аl(OH)3-гидроксид
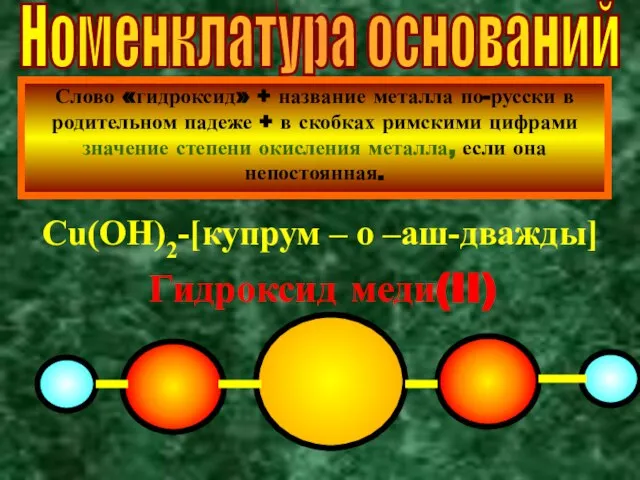
- 4. Номенклатура оснований Слово «гидроксид» + название металла по-русски в родительном падеже + в скобках римскими цифрами
- 5. Fe(OH)2-[феррум-о-аш-дважды] Гидроксид железа(II) Fe OH OH +2 Это кристаллическое вещество сине-зеленого цвета. Fe(OH)3-[феррум-о-аш-трижды] Гидроксид железа(III) Fe
- 6. получение оснований Растворимые в воде основания называются щелочами. Щелочи получаются непосредственным взаимодействием щелочных Ме (Ме, Є
- 7. Щелочи еще получаются взаимодействием оксидов щелочных Ме и оксидов щелочноземельных Ме с водой. К2О + Н2О
- 8. Щелочи еще можно получить взаимодействием гидридов щелочных Ме и гидридов щелочноземельных Ме с водой. NaН+Н2О =
- 9. Нерастворимые в воде основания получают по-другому: берут растворимую соль нужного Ме с определенной степенью окисления и
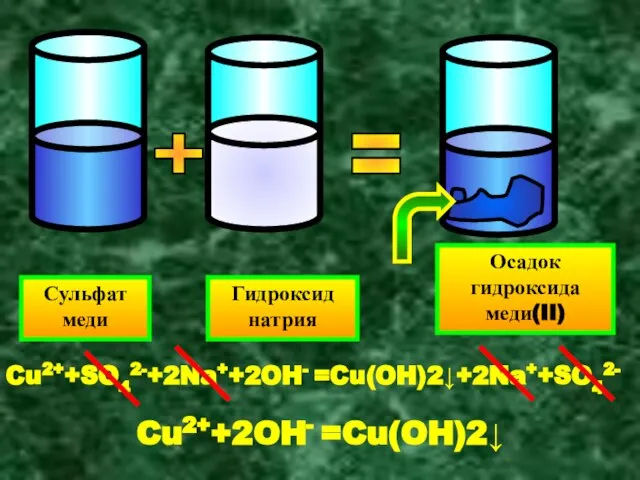
- 10. Сульфат меди Гидроксид натрия Осадок гидроксида меди(II) + = Cu2++SO42-+2Na++2OH- =Cu(OH)2↓+2Na++SO42- Cu2++2OH- =Cu(OH)2↓
- 11. Диссоциация оснований По теории С.Аррениуса основанием считается вещество, образующее при диссоциации гидроксид-анионы. Щелочи являются сильными электролитами⇒
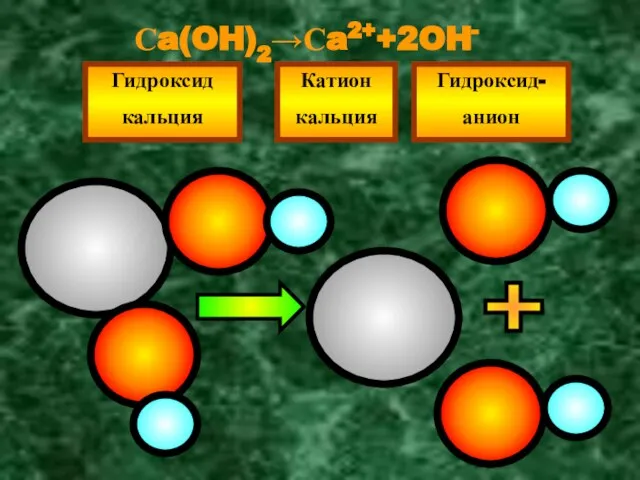
- 12. Сa(OH)2→Сa2++2OH- Гидроксид кальция Катион кальция Гидроксид- анион +
- 13. Запомни! Не путать понятия «растворимость вещества» и «сила электролита»! Гидроксид кальция плохо растворим в воде (
- 14. Многие малорастворимые в воде основания являются слабыми электролитами ⇒диссоциируют обратимо и ступенчато. Fe(OH)3 Fe(OH)2++ОН- Fe(OH)2+ FeOH2++ОН-
- 15. Обнаружение оснований Обнаружить основания (точнее, гидроксид-анионы) в растворе можно с помощью специальных веществ-индикаторов. №1 лакмус Нейтральная
- 16. А чтобы было легче запомнить окраску индикаторов, надо выучить стихи: лакмус Фиолетовый в воде,но такой он
- 17. №2 метилоранж Нейтральная среда Кислотная среда Щелочная среда От щелочи я желт, как в лихорадке. Краснею
- 18. №3 фенолфталеин Нейтральная среда Кислотная среда Щелочная среда В кислоте, в воде бесцветный, очень-очень неприметный. Зато
- 19. Оксиды и основания Оксиды, которым соответствуют гидроксиды-основания, называются основными. Это оксиды Ме главных подгрупп, а также
- 20. Известные основания КОН- едкое кали Белое, в растворе едкое вещество.Применение: Производство источников тока. Производство лекарств Производство
- 21. NaОН- едкий натр Тоже белое, в растворе едкое вещество. Применение: Кожевенное производство Производство искусственных волокон Производство
- 23. Скачать презентацию

![Fe(OH)2-[феррум-о-аш-дважды] Гидроксид железа(II) Fe OH OH +2 Это кристаллическое вещество сине-зеленого цвета.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/900696/slide-4.jpg)














 Соль и ее свойства. Добыча соли
Соль и ее свойства. Добыча соли Азотосодержащие органические соединения
Азотосодержащие органические соединения Методология пробoотбора с использованием ТЧЭ
Методология пробoотбора с использованием ТЧЭ Щелочные металлы
Щелочные металлы Кислород как вещество
Кислород как вещество смеси
смеси Основные понятия физической химии
Основные понятия физической химии Менделеевский период
Менделеевский период Распределение электронов в атоме по энергетическим уровням
Распределение электронов в атоме по энергетическим уровням Использование ИКТ в преподавании химии. Современный урок
Использование ИКТ в преподавании химии. Современный урок Основы МКТ
Основы МКТ Классификация неорганических веществ
Классификация неорганических веществ Щелочные металлы
Щелочные металлы Учебная мотивация как показатель качества образования (на уроках химии)
Учебная мотивация как показатель качества образования (на уроках химии) Классификация органических соединений
Классификация органических соединений Свойства алмаза
Свойства алмаза Углеводороды. 9 класс
Углеводороды. 9 класс Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Дисперсные системы
Дисперсные системы Кислородосодержащие органические вещества
Кислородосодержащие органические вещества Электроны в кристаллах. Приложения зонной теории
Электроны в кристаллах. Приложения зонной теории Серная кислота
Серная кислота Электролитическая диссоциация
Электролитическая диссоциация Олимпиадная подготовка
Олимпиадная подготовка Щелочные металлы
Щелочные металлы Алкадиены
Алкадиены Стекло. Определение стекла
Стекло. Определение стекла Реакции ионного обмена. Электролитическая диссоциация
Реакции ионного обмена. Электролитическая диссоциация