Содержание
- 2. С О Е Д И Н Е Н И Я С Е Р Ы
- 3. степень окисления серы -2 Сероводород - Н2S Сульфиды неметаллов – CS2, P2S3 Сульфиды металлов – Al2S3,
- 4. Н2S СЕРОВОДОРОД Это - ядовитый газ со специфическим запахом, тяжелее воздуха и кислорода, растворимый в воде.
- 5. Получение: водород + сера H2 + S ----H2S сульфид металла + сильная кислота ZnS + 2HCL---ZnCl2
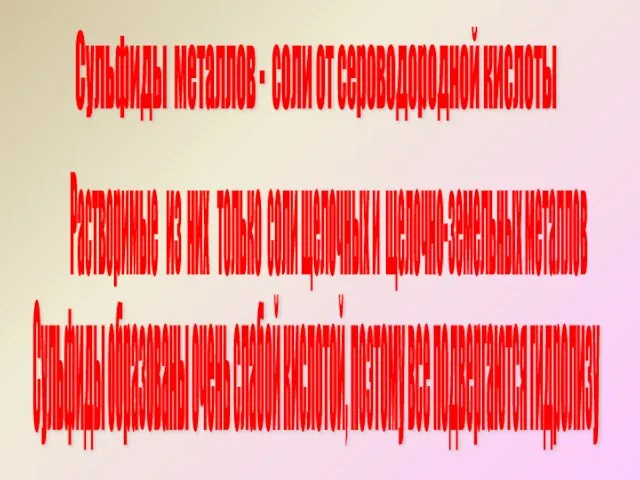
- 6. Сульфиды металлов - соли от сероводородной кислоты Сульфиды образованы очень слабой кислотой, поэтому все подвергаются гидролизу
- 7. степень окисления серы + 4 Сернистый газ –SO2 Сернистая кислота –H2SO3 Сульфиты – K2SO3, BaSO3
- 8. СЕРНИСТЫЙ ГАЗ SO2 Оксид серы(lV) – сернистый газ, являющийся одним из главных загрязнителей атмосферного воздуха, кислотный
- 9. Получение: разложение сернистой кислоты H2SO3 -----SO2 + H2O сгорание серы S + O2 ---SO2 обжиг сульфидов
- 10. Химические свойства: с водой SO2 + H2O---H2SO3 с основными оксидами SO2 + BaO---BaSO3 с щелочами SO2
- 11. Составьте уравнения реакций оксида серы (Vl) с водой, оксидом натрия, гидроксидом кальция, оксидом алюминия. Назовите продукты
- 12. Сернистая кислота – очень слабая, неустойчивая, легко разлагается на сернистый газ и воду (является аналогом угольной
- 13. степень окисления серы + 6 Серный ангидрид или оксид серы (Vl) –SO3 Серная кислота –H2SO4 Сульфаты
- 14. Оксид серы (Vl) – кислотный оксид, получается при окислении сернистого газа 2SO2 + O2---2SO3 Химические свойства
- 15. Н2SO4 Два вида солей от серной кислоты: средние – сульфаты CaSO4 и кислые – гидросульфаты Ba(HSO4)2
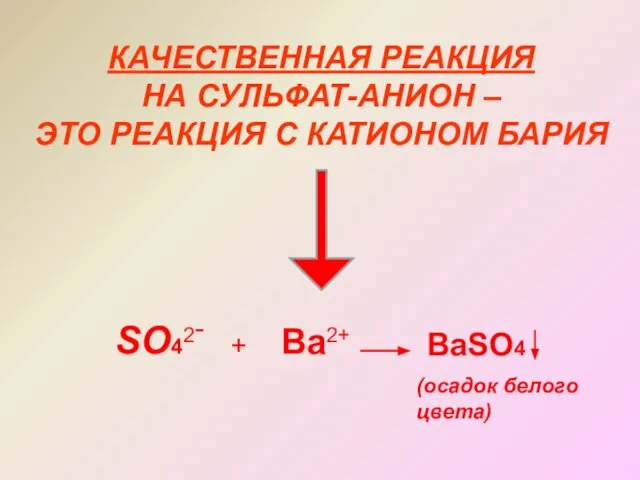
- 16. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА СУЛЬФАТ-АНИОН – ЭТО РЕАКЦИЯ С КАТИОНОМ БАРИЯ SO42- + Ba2+ BaSO4 (осадок белого
- 17. Н2SO4 Серная кислота - тяжелая бесцветная жидкость, которая бывает концентрированная и разбавленная, в зависимости от этого
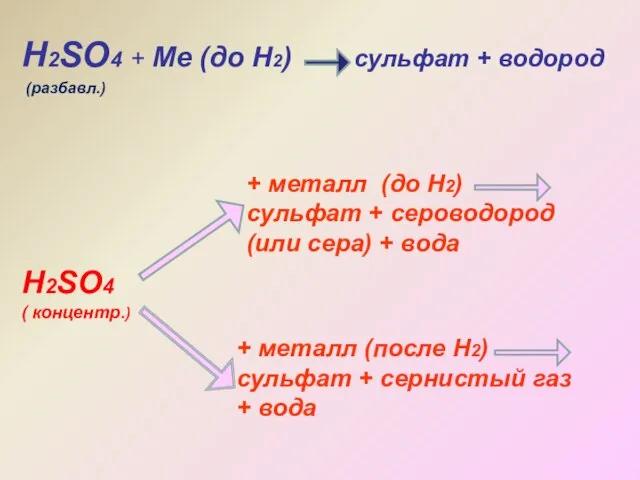
- 18. Взаимодействие разбавленной и концентрированной кислоты с металлами разной активности
- 19. Н2SO4 + Ме (до Н2) сульфат + водород Н2SO4 ( концентр.) + металл (до Н2) сульфат
- 20. Выполните задание по вариантам: 1 вариант – сернистый газ 2 вариант – серная кислота Вам даны
- 21. Это простое вещество Это соединение с высшей степенью окисления серы 3. Это сильный электролит 4. Это
- 22. Сульфат меди(ll) Сульфат алюминия Сульфат бария Сульфат хрома(lll) Сульфат железа(ll) Сульфат кобальта Найдите соответствие между названием
- 23. Самостоятельная работа по вариантам:
- 24. 1 вариант 2 вариант Составить о.в.р: Серная кислота разб. + натрий 2. Серная кислота разб. +
- 26. Скачать презентацию




















 Растворы, классификация растворов
Растворы, классификация растворов Углеводы. Общие представления об углеводах
Углеводы. Общие представления об углеводах Олеиновая кислота
Олеиновая кислота Химическая промышленность. Аварии на химических предприятиях
Химическая промышленность. Аварии на химических предприятиях Техносферная безопасность. Химия как наука
Техносферная безопасность. Химия как наука Амины
Амины Жиры. Техническая переработка жиров
Жиры. Техническая переработка жиров Кислоты. Тест
Кислоты. Тест Понятие электродного потенциала и методы его измерения
Понятие электродного потенциала и методы его измерения Химия крови. Состав и функции крови
Химия крови. Состав и функции крови Щелочноземельные металлы
Щелочноземельные металлы Аргентум, или серебро
Аргентум, или серебро Единый государственный экзамен по ХИМИИ (консультация 3) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР
Единый государственный экзамен по ХИМИИ (консультация 3) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР Сырье, продукты, параметры гидроочистки
Сырье, продукты, параметры гидроочистки Карбоновые кислоты. Тест. 10 класс
Карбоновые кислоты. Тест. 10 класс Массовая доля химического элемента
Массовая доля химического элемента Предельные углеводороды
Предельные углеводороды Именем Менделеева Д.И названы
Именем Менделеева Д.И названы Соли, их классификация и свойства
Соли, их классификация и свойства Валентность
Валентность Степень окисления
Степень окисления Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны
Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны Презентация на тему Полимеразная цепная реакция (ПЦР)
Презентация на тему Полимеразная цепная реакция (ПЦР)  Вебинар. Задачи из домашек по 27-29 задачам
Вебинар. Задачи из домашек по 27-29 задачам Презентация на тему Железо и его соединения (9 класс)
Презентация на тему Железо и его соединения (9 класс)  Химические уравнения
Химические уравнения Трансляция. Активирование аминокислоты
Трансляция. Активирование аминокислоты Кислоты и соли
Кислоты и соли