Содержание
- 2. Демокрит (около 460 до н.э— около 360 до н. э.) древнегреческий философ. Основоположник атомистического учения. Ввел
- 3. М.В. Ломоносов (1711-1765) Вошёл в науку как первый химик, обосновал учение об атомах и молекулах, дал
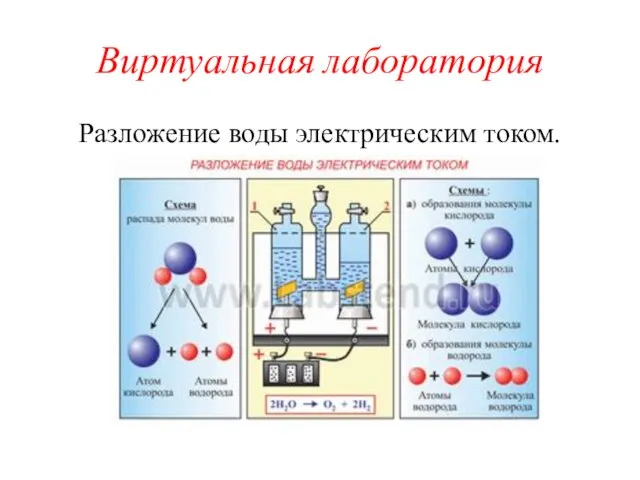
- 4. Виртуальная лаборатория Разложение воды электрическим током.
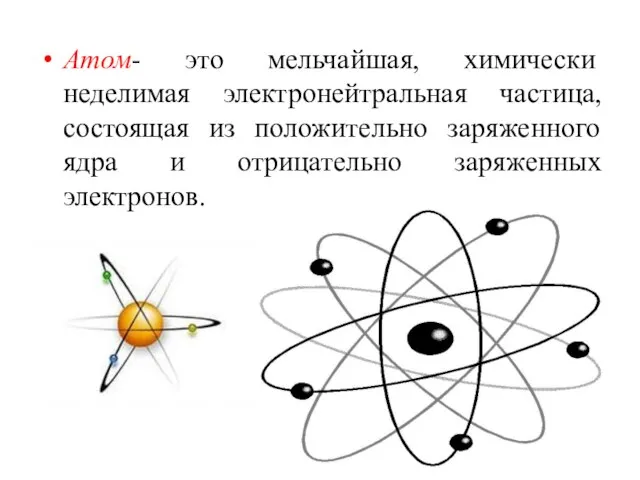
- 5. Атом- это мельчайшая, химически неделимая электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
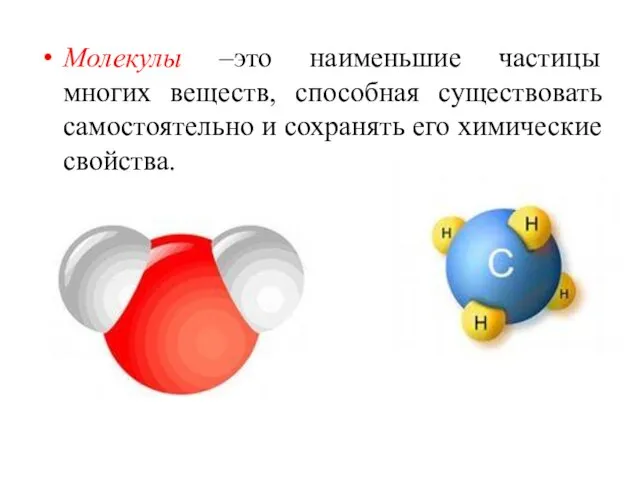
- 6. Молекулы –это наименьшие частицы многих веществ, способная существовать самостоятельно и сохранять его химические свойства.
- 7. Положения атомно-молекулярного учения 1. Вещества состоят из атомов; 2. При взаимодействии атомов образуются простые и сложные
- 8. Тема урока: Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток.
- 9. Агрегатные состояния вещества ЖИДКОЕ ТВЕРДОЕ ГАЗООБРАЗНОЕ Вода tпл=0 ° C tкип=100 ° C
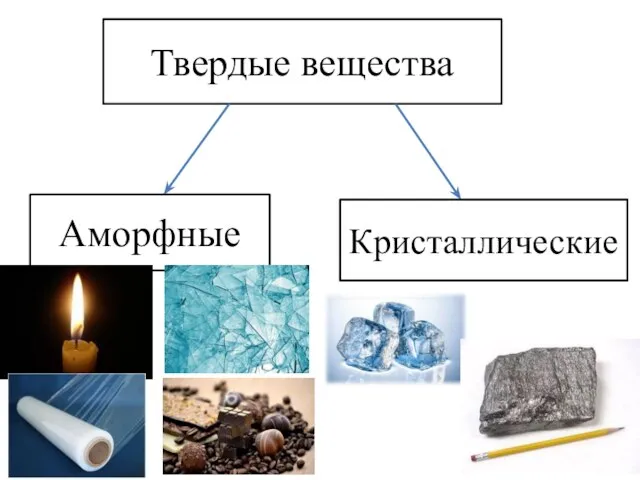
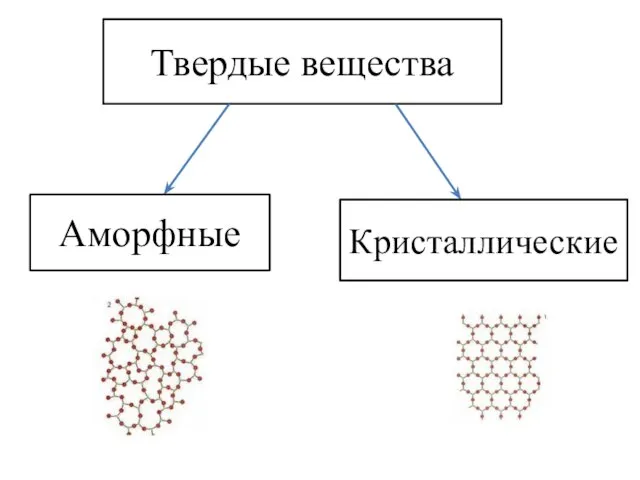
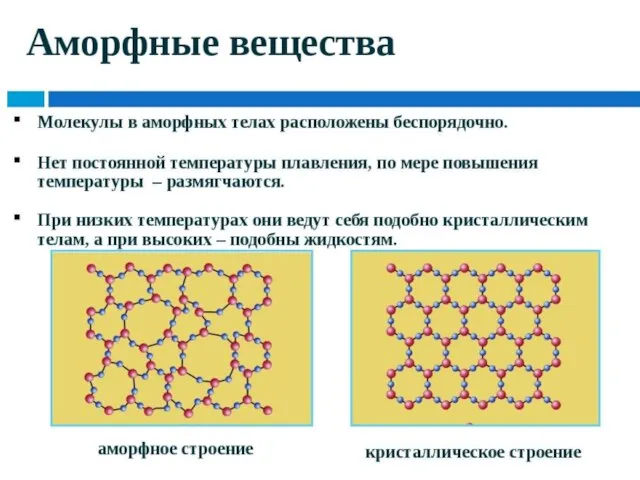
- 11. Твердые вещества Аморфные Кристаллические
- 12. Твердые вещества Аморфные Кристаллические
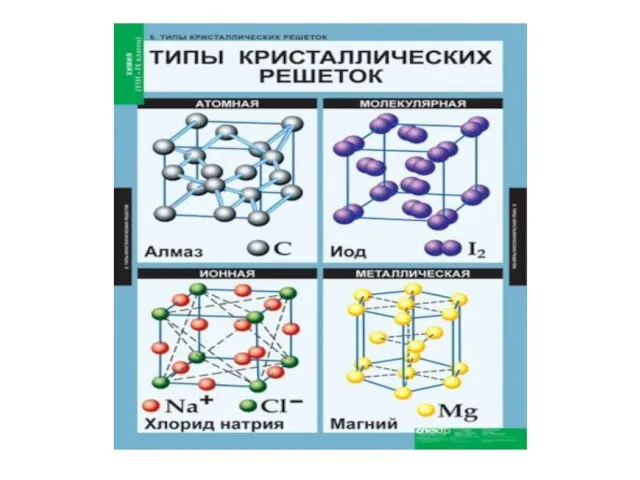
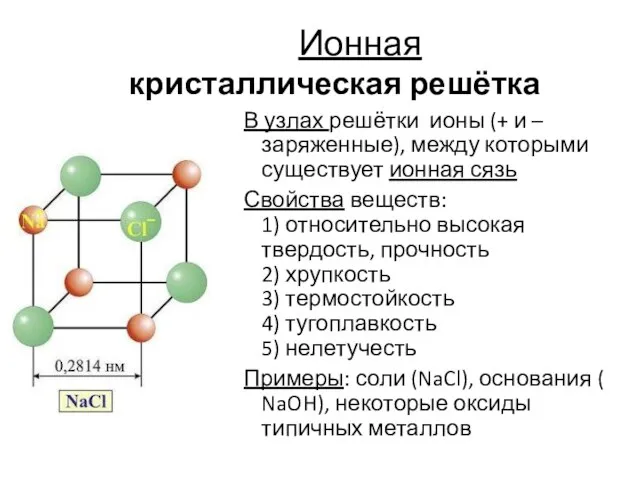
- 16. Ионная кристаллическая решётка В узлах решётки ионы (+ и – заряженные), между которыми существует ионная сязь
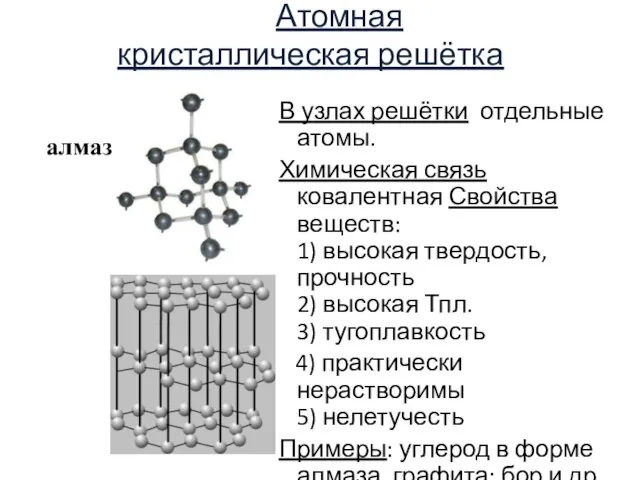
- 17. Атомная кристаллическая решётка В узлах решётки отдельные атомы. Химическая связь ковалентная Свойства веществ: 1) высокая твердость,
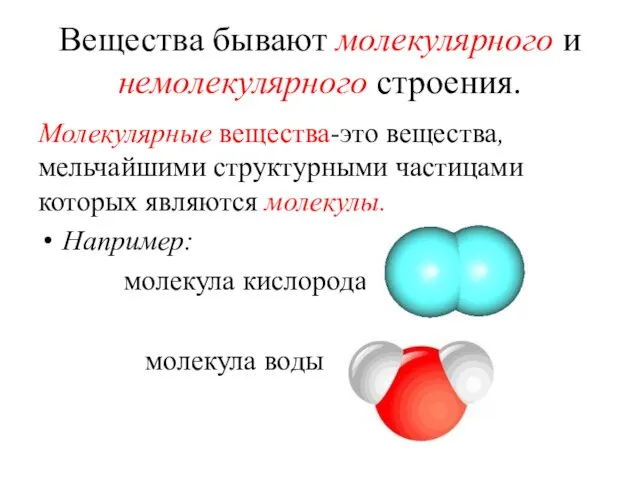
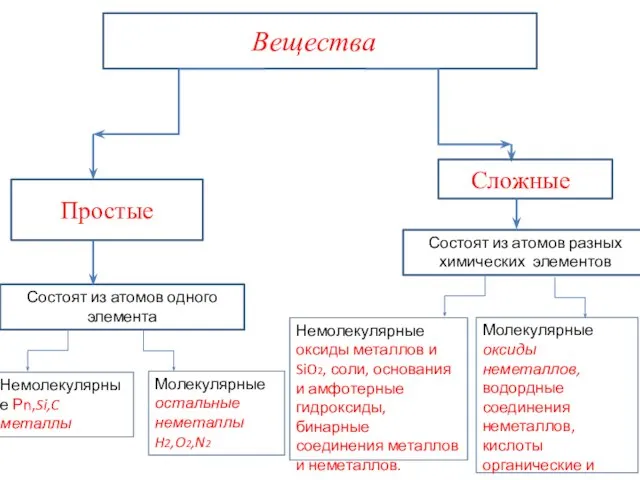
- 20. Вещества бывают молекулярного и немолекулярного строения. Молекулярные вещества-это вещества, мельчайшими структурными частицами которых являются молекулы. Например:
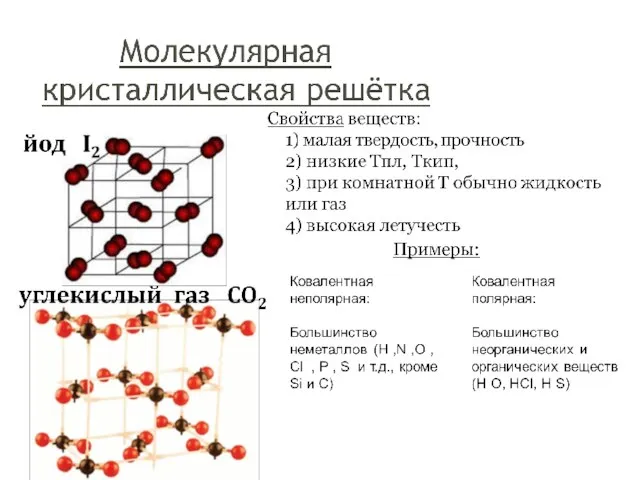
- 21. Молекулярные вещества имеют: Низкие температуры плавления и кипения; Находятся в стандартных условиях в твердом, жидком или
- 22. !!! К молекулярным веществам относятся: большинство простых веществ неметаллов: О2, S8 ,P4, H2, N2, Cl2 соединения
- 23. Немолекулярные вещества- это вещества, мельчайшими структурными частицами которых являются атомы или ионы. Немолекулярные вещества : находятся
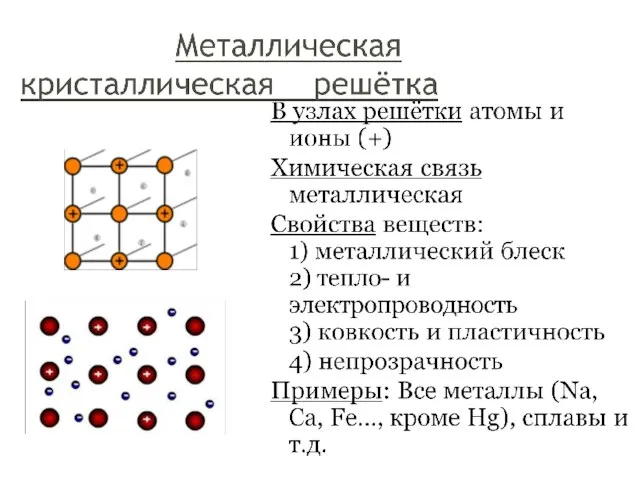
- 24. К немолекулярным веществам относятся: -простые вещества металлы и их сплавы: Cu, Na, Fe; -соединения металлов с
- 25. Состоят из атомов одного элемента Немолекулярные Рn,Si,C металлы Молекулярные оксиды неметаллов, водордные соединения неметаллов, кислоты органические
- 26. Получение сульфида железа Виртуальная лаборатория
- 27. Сопоставление Смесь Вещества можно смешать в любых массовых отношениях, т.е. состав смесей переменный . Вещества водящие
- 28. Закрепление 1. Допишите приведенные ниже предложения, заменив многоточия подходящими по смыслу понятиями «химический элемент», «атом», «молекула»:
- 30. Скачать презентацию













 Кислородосодержащие органические вещества
Кислородосодержащие органические вещества Менделеевский период
Менделеевский период Презентация на тему Угольная и кремниевая кислоты и их соли
Презентация на тему Угольная и кремниевая кислоты и их соли  Химические свойства воды
Химические свойства воды Практика по химии
Практика по химии Бензол
Бензол Химия в быту
Химия в быту Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот
Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ Алкены. Тестирование
Алкены. Тестирование Химическое ассорти
Химическое ассорти Водорастворимые витамины. 7 свойств водорастворимых витаминов
Водорастворимые витамины. 7 свойств водорастворимых витаминов Обобщение знаний об углеводородах
Обобщение знаний об углеводородах История развития органической химии
История развития органической химии Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха
Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха Презентация на тему Общая характеристика металлов главных подгрупп I-III
Презентация на тему Общая характеристика металлов главных подгрупп I-III  1_
1_ Коагуляция в дисперсных системах
Коагуляция в дисперсных системах Серная кислота
Серная кислота Переработка нефти. 10 класс
Переработка нефти. 10 класс Получение серной кислоты
Получение серной кислоты Альфа и бета распад. Правило смещения
Альфа и бета распад. Правило смещения Презентация на тему Углекислый газ
Презентация на тему Углекислый газ  Презентация на тему Химия и стирка
Презентация на тему Химия и стирка  Гипер-гипофосфатемия
Гипер-гипофосфатемия Оксиген та кисень
Оксиген та кисень Алициклические и гетероциклические соединения. Тема № 7, 8
Алициклические и гетероциклические соединения. Тема № 7, 8 Классы неорганических соединений (основания)
Классы неорганических соединений (основания)