Содержание
- 2. превращение одних веществ в другие. Вещества, полученные в результате реакции, отличаются от исходных веществ составом, строением
- 3. Признаки химических реакций Появление запаха Выделение газа Изменение окраски Выпадение осадка Растворение осадка Образование воды Выделение
- 4. Классификация по тепловому эффекту Эндотермические – с поглощением тепла + Q Экзотермические – с выделением тепла
- 5. Классификация по числу и составу исходных и образующихся веществ Реакции соединения: А + В = АВ
- 6. Тестовое задание. 1. Соотнесите: Тип реакции Схема реакции 1. замещения; а) 2ΗgO → 2Ηg+O2 ; 2.
- 7. 3. Реакции, в результате которых из одного сложного вещества образуется несколько более простого состава относятся к:
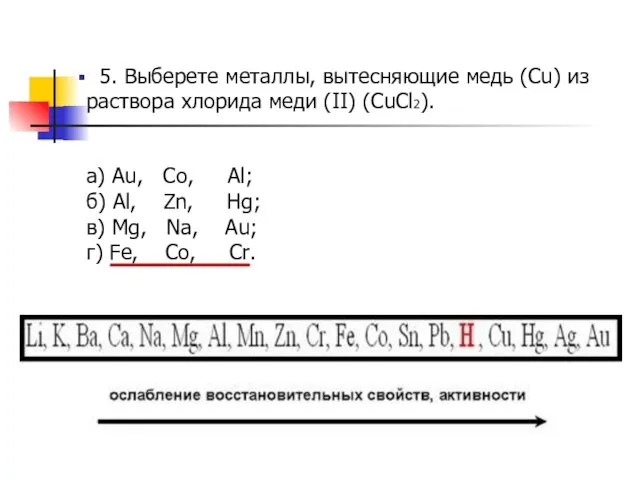
- 8. 5. Выберете металлы, вытесняющие медь (Cu) из раствора хлорида меди (II) (CuCl2). а) Au, Co, Al;
- 9. 6. По данным схемам реакций, запишите уравнения реакций. 1. Гидроксид меди (II) = оксид меди (II)
- 10. 6. Составьте уравнения последовательных реакций, используя подходящие реактивы: а) Ba → BaO → Ba(OH)2 → BaSO4
- 11. Домашнее задание Осуществите цепочку переходов S → SO2 → H2SO3 → Na2SO3 → SO2
- 13. Скачать презентацию









 Электролиз (катод)
Электролиз (катод) Химия элементов IVA группы
Химия элементов IVA группы Деформация аморфных и кристаллических полимеров
Деформация аморфных и кристаллических полимеров Диссоциация кислот
Диссоциация кислот Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях восстановление карбонильных соединений, кетены, поликарбонилы
восстановление карбонильных соединений, кетены, поликарбонилы Её величество – вода Интегрированный урок химии в 8 классе
Её величество – вода Интегрированный урок химии в 8 классе Презентация на тему Каучук
Презентация на тему Каучук  Аналитическая химия. Гомогенные растворы
Аналитическая химия. Гомогенные растворы Степень окисления
Степень окисления Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Алкены
Алкены Нуклеиновые кислоты
Нуклеиновые кислоты Тренажер. Типы химических реакций
Тренажер. Типы химических реакций Оценивание эффективности многофункциональной присадки для бензинов
Оценивание эффективности многофункциональной присадки для бензинов Дисперсные системы. Тест
Дисперсные системы. Тест Производство аммиака
Производство аммиака Проектная работа Кристаллизация
Проектная работа Кристаллизация proverochnaya_zadachi_1_ball_-_kopia (1)
proverochnaya_zadachi_1_ball_-_kopia (1) Этиленовые углеводороды
Этиленовые углеводороды Основания. Щелочи – растворимые основания
Основания. Щелочи – растворимые основания Реакции ионного обмена
Реакции ионного обмена Аллиты, ферриты, манганаты
Аллиты, ферриты, манганаты Природные кристаллы
Природные кристаллы Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1
Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1 Методы изготовления из резины и латекса
Методы изготовления из резины и латекса Урок-путешествие по теме «Первоначальные химические понятия»
Урок-путешествие по теме «Первоначальные химические понятия» Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1)
Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1)