Содержание
- 2. ОТКРЫТИЕ АЗОТА. В 1787 г Антуан Лавуазье подробно исследуя «ядовитый» и «дурной» воздухи, установил, что это
- 3. ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА. При обычных условиях: газ, без цвета, запаха, вкуса. Растворимость в воде 23 мл/л
- 4. СТРОЕНИЕ АЗОТА. Символ: N Строение атома и молекулы азота: Элемент группы VA. Заряд ядра +7, в
- 5. НАХОЖДЕНИЕ В ПРИРОДЕ. В основном в свободном состоянии в атмосфере – 78% по объему. Входит в
- 6. ХИМИЧЕСКИЕ СВОЙСТВА АЗОТА. Вступает в химические реакции в жестких условиях. 1) При обычных условиях реагирует только
- 7. ПРИМИНЕНИЕ И ПОЛУЧЕНИЕ АЗОТА. Применение: Получение аммиака Создание низких температур Насыщение поверхности стали для повышения прочности
- 8. ОКСИДЫ АЗОТА. N2O NO N2O3 NO2 N2O5
- 9. ОКСИД АЗОТА (I) N2O. Закись азота, «веселящий газ». Бесцветный газ со слабым запахом, растворим в воде.
- 10. ОКСИД АЗОТА (II) NO. Бесцветный газ, незначительно растворим в воде, ядовит. Безразличный (несолеобразующий) оксид. Реагирует с
- 11. ОКСИД АЗОТА (III) N2O3. Газ, очень токсичен, вызывает ожоги кожи. Неустойчив при обычных условиях Взаимодействует с
- 12. ОКСИД АЗОТА (IV) NO2. Газ бурого цвета, тяжелее воздуха, ядовит. Реагирует с водой с образованием азотистой
- 13. ОКСИД АЗОТА (V) N2O5. Кристаллическое вещество, крайне неустойчиво, ядовито. Обладает свойствами кислотного оксида.
- 14. ЖИДКИЙ АЗОТ. Жидкий азот - не взрывоопасен и не ядовит. Жидкость прозрачного цвета. Испаряясь, азот охлаждает
- 16. Скачать презентацию













 Физические свойства металлов
Физические свойства металлов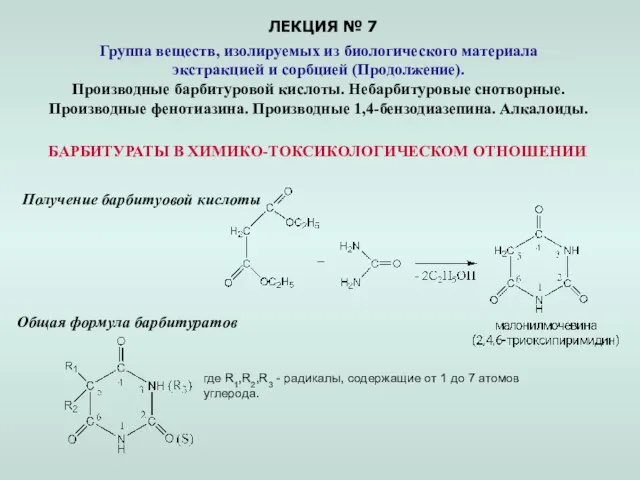 Презентация по Химии "Группа веществ, изолируемых из биологического материала экстракцией и сорбцией"
Презентация по Химии "Группа веществ, изолируемых из биологического материала экстракцией и сорбцией"  Предельные одноатомные спирты
Предельные одноатомные спирты Соединения галогенов
Соединения галогенов Вяжущие вещества
Вяжущие вещества Виды изомерии у моносахаридов
Виды изомерии у моносахаридов Мышьяк
Мышьяк Неметаллы. Особенности электронного строения атомов НМ
Неметаллы. Особенности электронного строения атомов НМ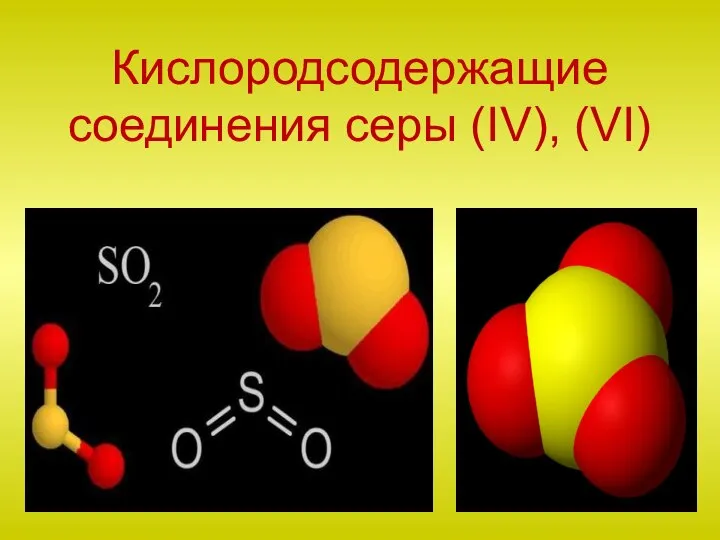 Кислородсодержащие соединения серы (IV), (VI)
Кислородсодержащие соединения серы (IV), (VI) Искусственные полимеры
Искусственные полимеры Общая химическая технология. Тепловой (энергетический) баланс. Практическое занятие 7
Общая химическая технология. Тепловой (энергетический) баланс. Практическое занятие 7 4. Диаграмма железо-углерод
4. Диаграмма железо-углерод Классификация химических реакций
Классификация химических реакций Химические свойства кислот
Химические свойства кислот Основные понятия химической кинетики. Скорость химической реакции
Основные понятия химической кинетики. Скорость химической реакции Химия в игре. Проектная работа
Химия в игре. Проектная работа АТФ и другие органические соединения клетки
АТФ и другие органические соединения клетки Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы
Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы агрегатные состояния вещества 7 класс
агрегатные состояния вещества 7 класс Великий закон Дмитрия Ивановича Менделеева
Великий закон Дмитрия Ивановича Менделеева Порядковый номер элемента. Изотопы
Порядковый номер элемента. Изотопы Ароматические и ненасыщенные альдегиды и кетоны
Ароматические и ненасыщенные альдегиды и кетоны Презентация на тему Синтетические материалы
Презентация на тему Синтетические материалы  Дисперсные системы
Дисперсные системы Әртүрлі заттардың кристаллдық тор энергиясын, сольваттану энергиясын, гидратация жылуын есептеу
Әртүрлі заттардың кристаллдық тор энергиясын, сольваттану энергиясын, гидратация жылуын есептеу Презентация на тему Игра «Путешествие в страну Атомолия»
Презентация на тему Игра «Путешествие в страну Атомолия»  Строение и химические свойства глюкозы
Строение и химические свойства глюкозы Полипропилен (ПП)
Полипропилен (ПП)