Слайд 2
1. Преобразуйте схемы в уравнения реакций, укажите тип реакции:
А) K + O2

--> K2O
Б) N2 + H2 --> NH3
В) NH4NO3 --> N2O + H2O
Г) Al + FeO --> Al2O3 + Fe
Д) NaOH + H2SO4 --> Na2SO4 + H2O
Слайд 3
2. Закончите уравнения реакций. Расставьте коэффициенты.
А) соединения: N2 + Li -->
H2

+ Cl2 -->
Б) разложения: СаСО3 -->
В) замещения:
Al + H2SO4 -->
Г) обмена:
Al(OH)3 + NaNO3 -->
Слайд 43. Решите задачу:
Нагретый порошок железа сгорает в хлоре. В результате образуется хлорид

железа (III), который используется для травления плат в электротехнике. Рассчитайте массу железа, которая потребуется для получения 381 г хлорида железа (III).



 Химические свойства амфотерных оксидов и гидроксидов
Химические свойства амфотерных оксидов и гидроксидов Презентация на тему Электролиз: что полезно знать
Презентация на тему Электролиз: что полезно знать 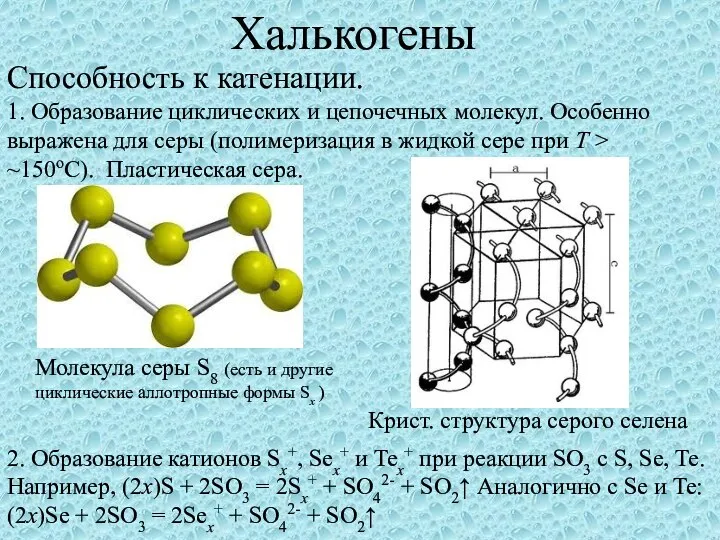 Халькогены. Способность к катенации
Халькогены. Способность к катенации Урок-путешествие по теме «Первоначальные химические понятия»
Урок-путешествие по теме «Первоначальные химические понятия» Относительная атомная масса Урок 8 класс Учитель химии Чиркунова Л.А.
Относительная атомная масса Урок 8 класс Учитель химии Чиркунова Л.А. Резиновые материалы и клеи. Тема 7.5
Резиновые материалы и клеи. Тема 7.5 Свойства жидкостей
Свойства жидкостей Азот и его соединения
Азот и его соединения Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Алкины и их свойства
Алкины и их свойства Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов
Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов Презентация на тему Глюкоза (10 класс)
Презентация на тему Глюкоза (10 класс)  Производство метанола
Производство метанола Презентация на тему Химическая промышленность мира
Презентация на тему Химическая промышленность мира  Занимательная химия Программу составил
Занимательная химия Программу составил  Составление ионных уравнений
Составление ионных уравнений Химическая связь в комплексных соединениях
Химическая связь в комплексных соединениях Презентация на тему Железо 9 класс
Презентация на тему Железо 9 класс  Презентация на тему Классификация химических реакций 11 класс
Презентация на тему Классификация химических реакций 11 класс 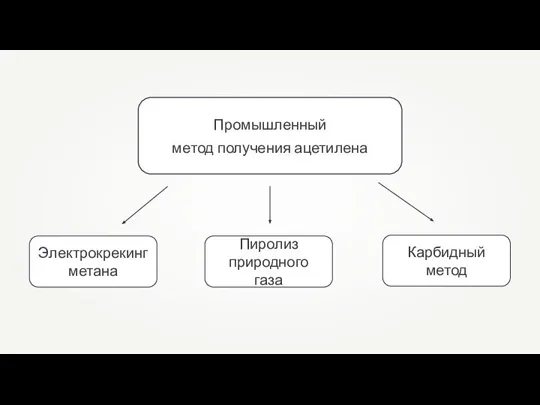 Промышленный метод получения ацетилена
Промышленный метод получения ацетилена Презентация на тему Основные понятия химии
Презентация на тему Основные понятия химии  Взаимодействие молекул (7 класс)
Взаимодействие молекул (7 класс) Актиний. Нахождение в природе
Актиний. Нахождение в природе Хим_10_30_Производство_аммиака
Хим_10_30_Производство_аммиака Показатель активности водородных ионов. Лабораторная работа №4
Показатель активности водородных ионов. Лабораторная работа №4 Проверочный тест. Номенклатура алканов
Проверочный тест. Номенклатура алканов Презентация на тему Количество вещества
Презентация на тему Количество вещества  Неметаллы азот
Неметаллы азот