Содержание
- 2. 1. Атомы каких элементов входят в состав всех органических веществ? А. углерода Б. углерода и водорода
- 3. 1. Атомы каких элементов входят в состав всех органических веществ? Б. углерода и водорода
- 4. 2. Какова электронная формула атома углерода в возбуждённом состоянии? А. 1s2 2s2 2p4 Б. 1s2 2s2
- 5. Какова электронная формула атома углерода в возбуждённом состоянии? В. 1s2 2s1 2p3
- 6. 3. Какова валентность атома углерода в органических веществах? А. I Б. II В. III Г. IV
- 7. Какова валентность атома углерода в органических веществах? Г. IV
- 8. 4. Какова валентность атома азота в органических веществах? А. II Б. III В. IV Г. V
- 9. Какова валентность атома азота в органических веществах? Б. III
- 10. Какое строение имеют большинство органических веществ? А. атомное Б. ионное В. металлическое Г. молекулярное
- 11. Какое строение имеют большинство органических веществ? Г. молекулярное
- 12. 5. В молекуле какого вещества наиболее прочная химическая связь? А. F2 Б. Cl2 В. O2 Г.
- 13. В молекуле какого вещества наиболее прочная химическая связь? Г. N2
- 14. 6. Кто является автором теории химического строения органических веществ? А. Бутлеров Б. Менделеев В. Кекуле Г.
- 15. Ответы: Б. углерода и водорода В. 1s2 2s1 2p3 Г. IV Г. молекулярное Г. N2 А.
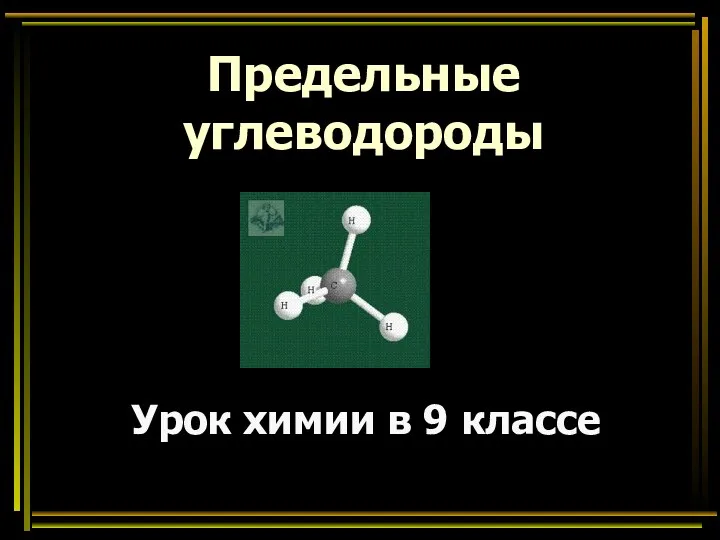
- 16. Предельные углеводороды Урок химии в 9 классе
- 17. Углеводороды (УВ) – органические вещества, состоящие только из атомов углерода и водорода
- 18. Эти два элемента – С и Н, образовали громадное число соединений - углеводородов: СnHm И углерод
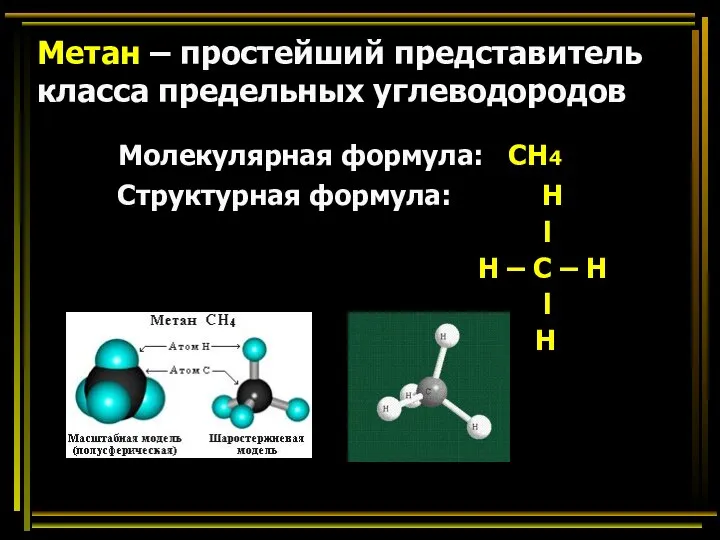
- 19. Метан – простейший представитель класса предельных углеводородов Молекулярная формула: СН4 Структурная формула: Н l Н –
- 20. Простейший У.В. содержит один атом углерода, имеет формулу СН4 и называется метаном. Метан – газ, б/ц
- 21. В метане все четыре связи атома углерода насыщены атомами водорода максимально. Поэтому метан относится к предельным
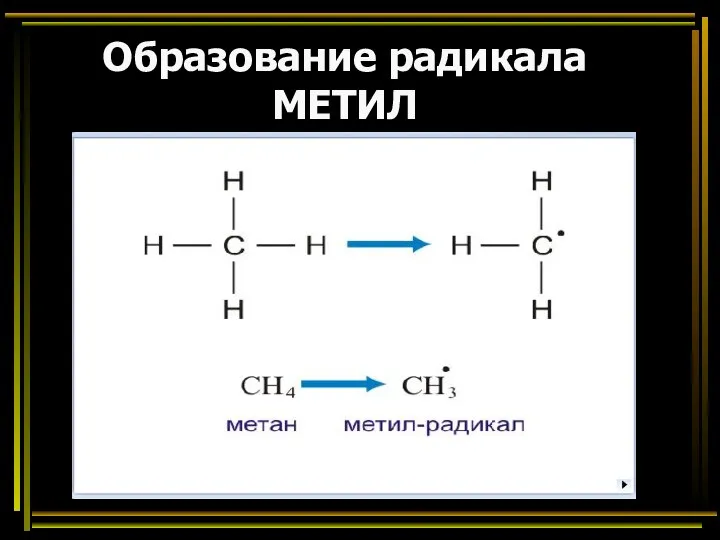
- 22. Образование радикала МЕТИЛ
- 23. Предельные углеводороды – алканы, насыщенные углеводороды, парафины.
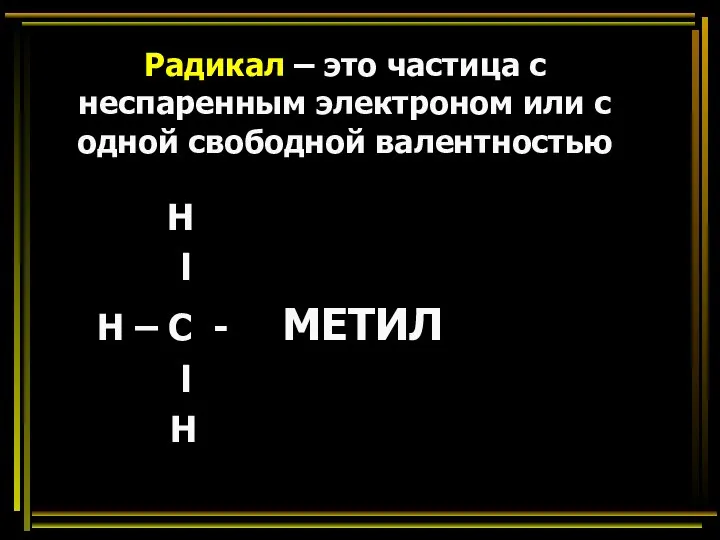
- 24. Радикал – это частица с неспаренным электроном или с одной свободной валентностью Н l Н –
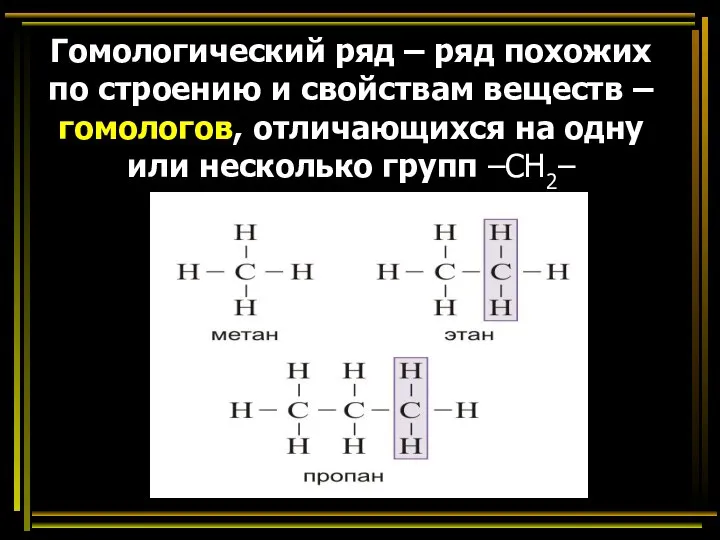
- 25. Гомологический ряд – ряд похожих по строению и свойствам веществ – гомологов, отличающихся на одну или
- 26. Соединив между собой два радикала метила, можно получить ближайший родственник метана - этан: СН3- + СН3-
- 27. Алканы (предельные, насыщенные, парафины) – органические вещества, состоящие из атомов углерода и водорода, связанных между собой
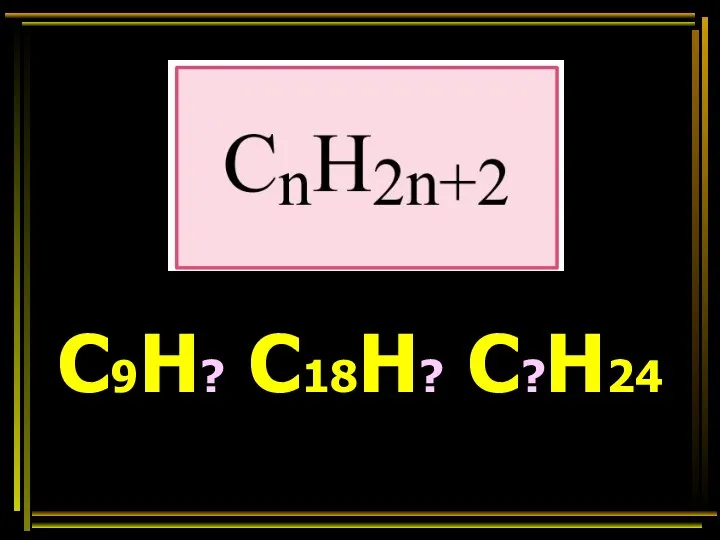
- 28. С9Н? С18Н? С?Н24
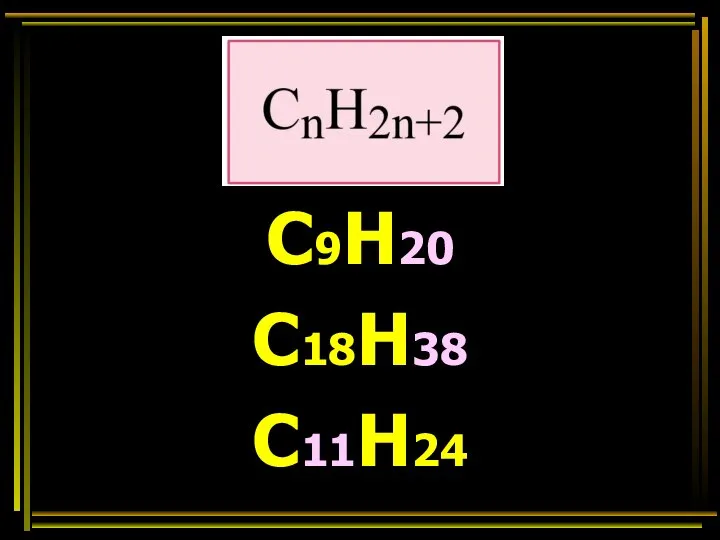
- 29. С9Н20 С18Н38 С11Н24
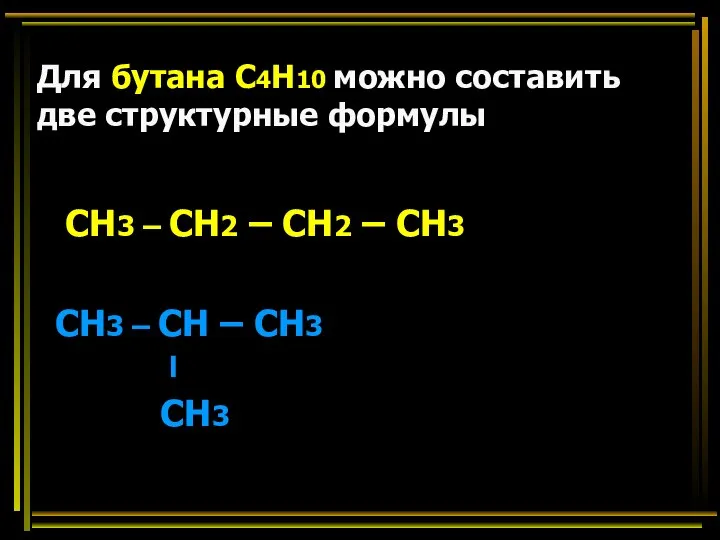
- 30. Для бутана С4Н10 можно составить две структурные формулы СН3 – СН2 – СН2 – СН3 СН3
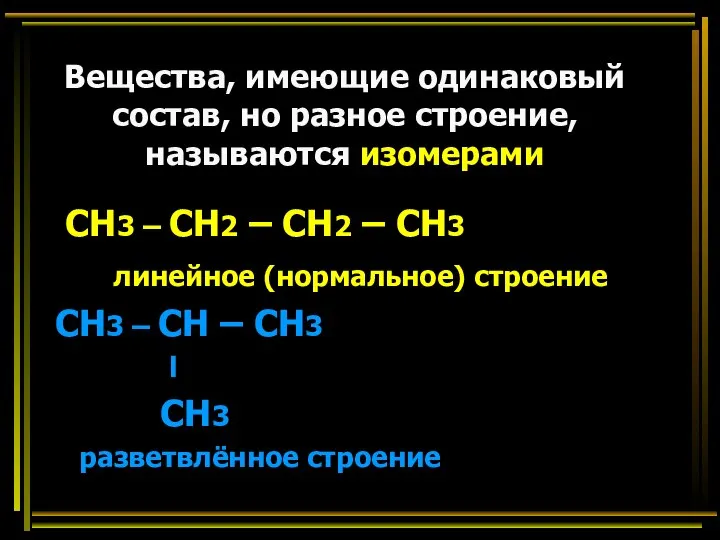
- 31. Вещества, имеющие одинаковый состав, но разное строение, называются изомерами СН3 – СН2 – СН2 – СН3
- 32. Изомерия, изомеры
- 33. Метан при температуре более 1500°С распадается на углерод (образуется сажа) и водород: СН4 → С +2Н2↑
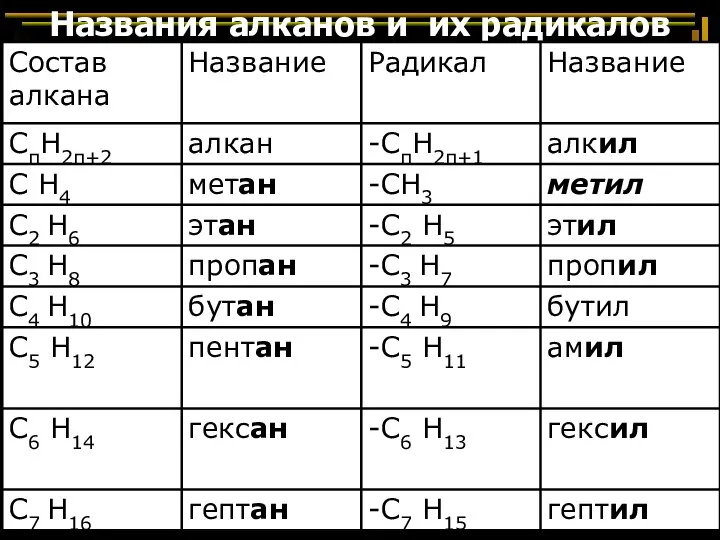
- 34. Названия алканов и их радикалов
- 35. Номенклатура алканов СН3 1 2l 3 4 СН3 – С – СН2 – СН3 l СН3
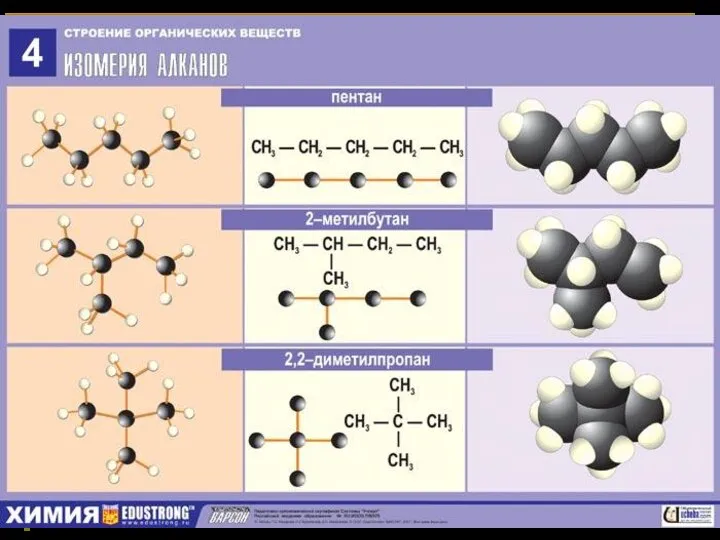
- 36. Изомеры пентана
- 37. Химические свойства алканов Реакция горения Реакция замещения c галогенами Реакция термического разложения – дегидрирования
- 38. Уравнение реакции горения метана
- 39. Нахождение в природе: Природный газ на 75%-85% состоит из метана, от 25%-2% этана, пропана и других
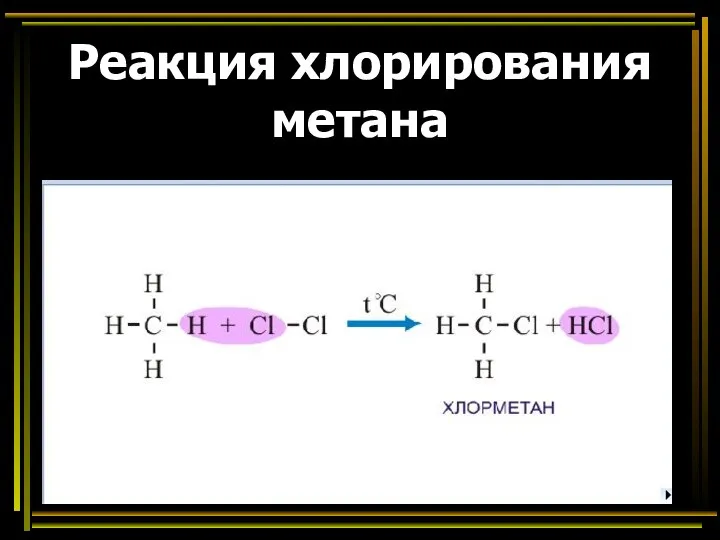
- 40. Реакция хлорирования метана
- 41. Термическое разложение метана
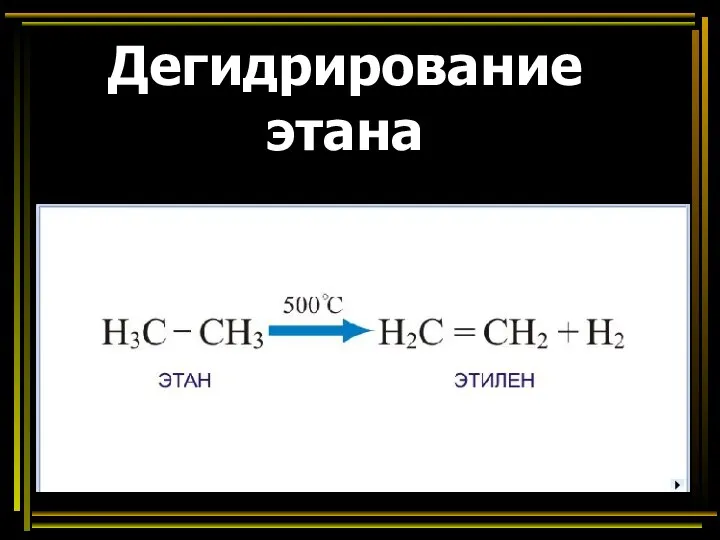
- 42. Дегидрирование этана
- 43. Учёные-химики, которые внесли вклад в изучение углеводородов Владимир Васильевич Марковников (1838-1904) Михаил Иванович Коновалов(1858 – 1906)
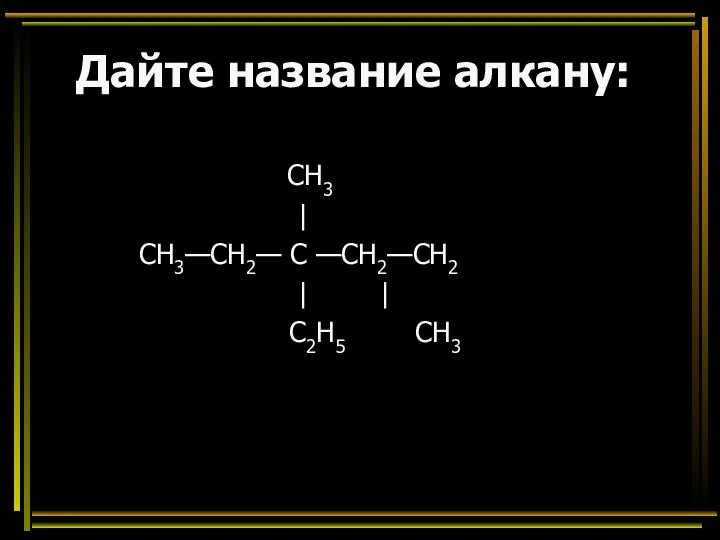
- 44. Дайте название алкану: CH3 | СН3—СН2— С —СН2—СН2 | | C2H5 CH3
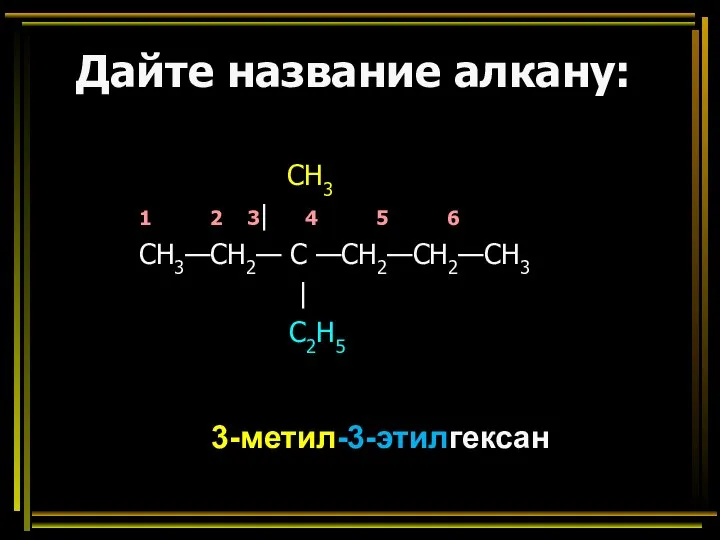
- 45. Дайте название алкану: CH3 1 2 3| 4 5 6 СН3—СН2— С —СН2—СН2—СН3 | C2H5 3-метил-3-этилгексан
- 46. Нефть – источник жидких углеводородов Нефть была известна ещё в античные времена и использовалась в основном
- 47. Нефть: ОПАСНОСТЬ!!! Подсчитано, что 200 тыс. тонн нефти достаточно, чтобы превратить все Балтийское море в биологическую
- 49. Скачать презентацию































 Химический элемент азот N и его соединения
Химический элемент азот N и его соединения Оксиды
Оксиды Простое вещество и химический элемент азот
Простое вещество и химический элемент азот Презентация на тему Бинарные соединения
Презентация на тему Бинарные соединения  Железо
Железо Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5)
Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5) ТБ_1 (1)
ТБ_1 (1) Презентация на тему Эфирные масла
Презентация на тему Эфирные масла  Получение меди
Получение меди Магний для растений
Магний для растений Блеск и сила волос с точки зрения химии
Блеск и сила волос с точки зрения химии Презентация на тему Применение спиртов
Презентация на тему Применение спиртов  Металлы d-элементы
Металлы d-элементы Дополнительный_материал_11.15_23.09.2022_e4f87550
Дополнительный_материал_11.15_23.09.2022_e4f87550 Азотные удобрения
Азотные удобрения Сплавы со специальными свойствами
Сплавы со специальными свойствами Расчетная работа. Тепловой эффект клинкерообразования
Расчетная работа. Тепловой эффект клинкерообразования Определение плотности газообразного вещества по плотности
Определение плотности газообразного вещества по плотности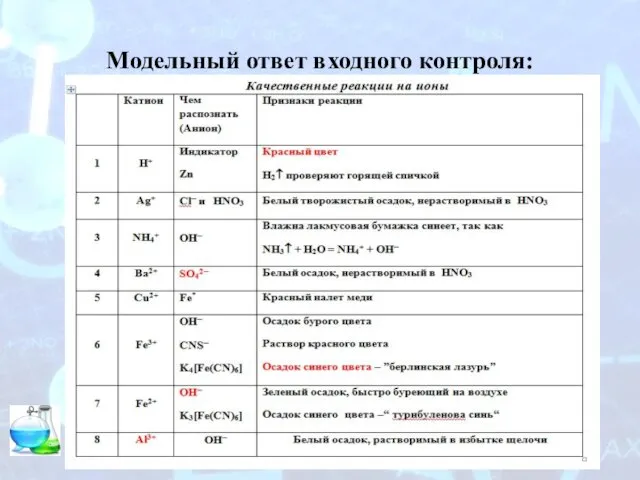 Модельный ответ входного контроля
Модельный ответ входного контроля Турнир смекалистых. Все о кислотах
Турнир смекалистых. Все о кислотах Презентация на тему Правила безопасности труда в кабинете химии
Презентация на тему Правила безопасности труда в кабинете химии  Углеводороды. Алкены, этилен
Углеводороды. Алкены, этилен Презентация на тему Неорганические и органические основания
Презентация на тему Неорганические и органические основания  Непредельные карбоновые кислоты
Непредельные карбоновые кислоты Харктеристика металлов
Харктеристика металлов Алканы
Алканы Понятие электродного потенциала и методы его измерения
Понятие электродного потенциала и методы его измерения Premeny látok. Horenie ako chemická reakcia
Premeny látok. Horenie ako chemická reakcia