Слайд 2Повторение изученного материала.
1) проверка Д/З
Стр. 225 №5 – 2 человека у доски
2)

стр. 225 №6 – 1 человек у доски
3) Остальные пишут С/Р
Слайд 3Работа по теме урока
? Что за вещество, являясь жидкостью, «дымит» на воздухе?
?

Перечислите его общие свойства с подобными ему веществами.
Слайд 4Формулирование темы урока
А может ли вещество обладать своими уникальными свойствами?
Сформулируйте тему нашего

сегодняшнего урока.
Слайд 5Специфические свойства азотной кислоты.

Слайд 6Специфичеческие свойства азотной кислоты
1) Разложение азотной кислоты:
4HNO3 = 4NO2 + 2H2O

+ O2
2) Взаимодействие с органическими веществами (ТБ)
HNO3 + белок = ярко-желтое вещество
Слайд 7Специфичеческие свойства азотной кислоты
Взаимодействие с металлами: (искл. Pt, Au)
HNO3 +

Me = Me(NO3)x + H2O + ?
Почему азотная кислота концентрированная не реагирует с железом, алюминием и хромом?
Слайд 8Отработка уравнений реакций
Уравняйте методом электронного баланса:
Cu + HNO3 (р) =
Cu + HNO3

(к) =
Ca + HNO3 (р) =
Ва + HNO3 (к) =







 Презентация на тему Состав, строение и свойства стекла и хрусталя
Презентация на тему Состав, строение и свойства стекла и хрусталя  Электролиз. Законы Фарадея
Электролиз. Законы Фарадея Жиры (липиды)
Жиры (липиды) Стеариновая кислота
Стеариновая кислота Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Производство аммиака
Производство аммиака смеси
смеси Презентация на тему Вопросы от …
Презентация на тему Вопросы от …  Классификация и номенклатура аминов. 11 класс
Классификация и номенклатура аминов. 11 класс Органическая химия
Органическая химия Химические методы. Качественные реакции, титрование, колорометрический метод
Химические методы. Качественные реакции, титрование, колорометрический метод Классификация, номенклатуры, изомерия
Классификация, номенклатуры, изомерия Алюминий
Алюминий Кислород
Кислород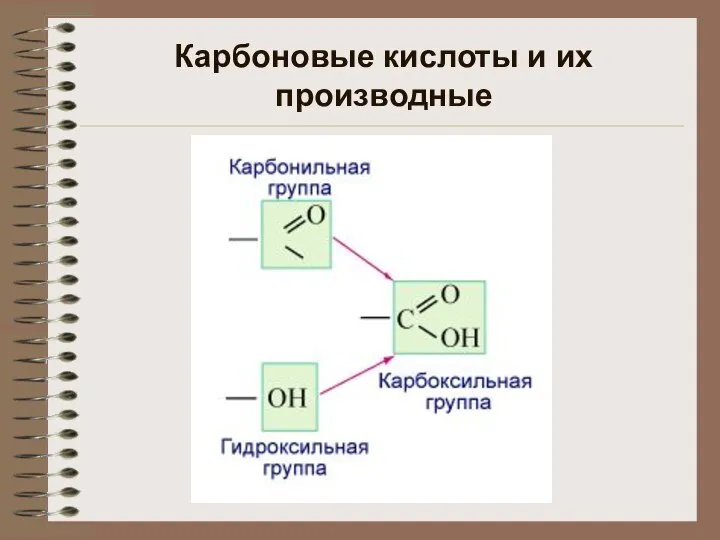 Карбоновые кислоты и их производные
Карбоновые кислоты и их производные Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений lektsia_7
lektsia_7 Центробежное осаждение
Центробежное осаждение Алкены
Алкены Кристаллическое состояние воды - лёд
Кристаллическое состояние воды - лёд Коллоидная химия
Коллоидная химия Презентация на тему Кальций
Презентация на тему Кальций  Оптические свойства веществ
Оптические свойства веществ Витамины. (10 класс)
Витамины. (10 класс) Exotermické a endotermické reakcie
Exotermické a endotermické reakcie Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома Алюминий
Алюминий Топливо и расчеты его горения
Топливо и расчеты его горения