Содержание
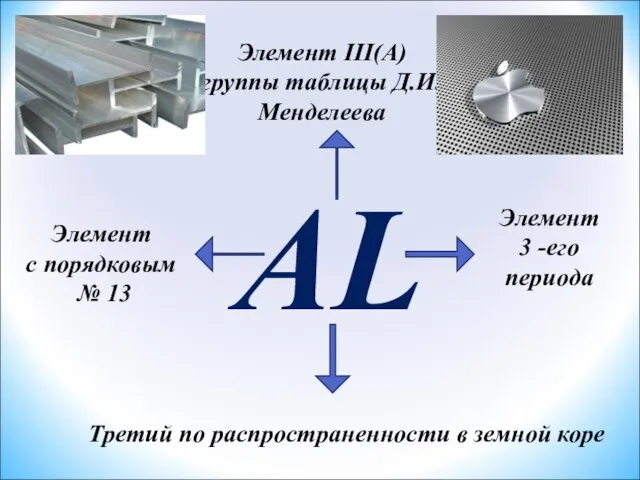
- 2. AL Элемент III(A) группы таблицы Д.И.Менделеева Элемент с порядковым № 13 Элемент 3 -его периода Третий
- 3. Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид
- 4. Получение Современный метод получения был разработан независимо друг от друга американцем Чарльзом Холлом и французом Полем
- 5. Чарльз Холл Холл Чарльз (1863 – 1914)- американский инженер-химик. Будучи студентом Оберлинского колледжа, на лекциях узнал,
- 6. Поль Эру В начале 1886 года он изобрел такой же метод промышленного получения алюминия электролизом криолитно-глиноземного
- 7. Нахождение в природе Важнейшим на сегодня минералом алюминия является боксит , основа которого оксид алюминия(AL2O3) .
- 8. Легко реагирует с простыми веществами: с кислородом, образуя оксид алюминия: 4Al + 3O2 = 2Al2O3 с
- 9. Химические свойства Со сложными веществами: с водой (после удаления защитной оксидной пленки) 2Al + 6H2O =
- 10. ПРИМЕНЕНИЕ АЛЮМИНИЯ
- 12. Скачать презентацию








 карбоновые кислоты
карбоновые кислоты Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Electrochemical properties of arylsilanes
Electrochemical properties of arylsilanes Стехиометрические законы химии
Стехиометрические законы химии 1_Лекція Комплексн
1_Лекція Комплексн Карбоновые кислоты. Альдегиды
Карбоновые кислоты. Альдегиды Серная кислота
Серная кислота Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов
Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов Диссоциация кислот, щелочей, солей
Диссоциация кислот, щелочей, солей Дисперсные системы
Дисперсные системы Кислоты. Общая формула кислот
Кислоты. Общая формула кислот Биопластик на основе лигнина
Биопластик на основе лигнина Иерархия классов методов моделирования. Атомистические и микроскопические методы
Иерархия классов методов моделирования. Атомистические и микроскопические методы Вода и ее свойства
Вода и ее свойства Химическая связь
Химическая связь Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс
Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс Камень, скользящий на льду
Камень, скользящий на льду Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз
Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алканы. Циклоалканы
Алканы. Циклоалканы Расчётно-графическая работа по теме Мыловарение
Расчётно-графическая работа по теме Мыловарение Презентация на тему Задачи на смеси и сплавы (9 класс)
Презентация на тему Задачи на смеси и сплавы (9 класс)  Химия в профессии ювелира
Химия в профессии ювелира Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Органическая химия и пищевые добавки
Органическая химия и пищевые добавки Обсидиан
Обсидиан Первое начало термодинамики (Закон сохранения и превращения энергии)
Первое начало термодинамики (Закон сохранения и превращения энергии) Химия вокруг нас. 10 класс
Химия вокруг нас. 10 класс