Содержание
- 2. «Просто знать – мало, знания нужно уметь использовать» Гёте
- 3. Определите валентность углерода: Какие формулы веществ вам знакомы, назовите их. СО2 ;СН4;С4Н10 ;С2Н6 ;С3Н8 IV IV
- 4. Применение метана – СН4. метан – является основным компонентом природных попутных газов и широко используется в
- 5. Напишите формулы метана : а) молекулярную формулу б) электронную формулу в) структурную формулу. Что означает каждая
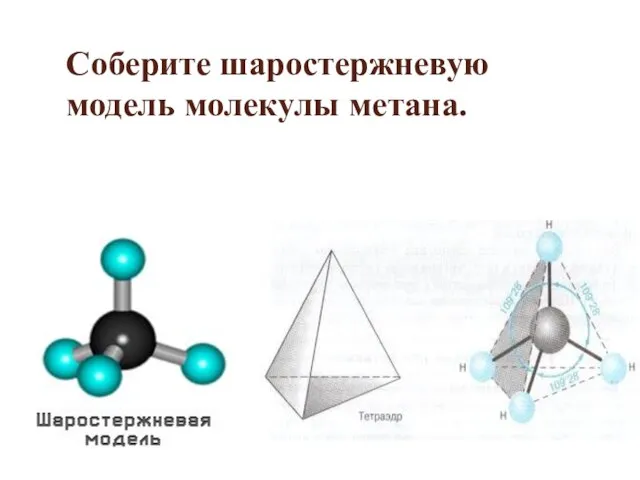
- 6. Соберите шаростержневую модель молекулы метана.
- 7. Вы не смогли определить валентность в С2Н6; С3Н8; С4Н10 . Углеводороды - это органические соединения, состоящие
- 8. Тема урока: «Пространственное строение углеводородов».
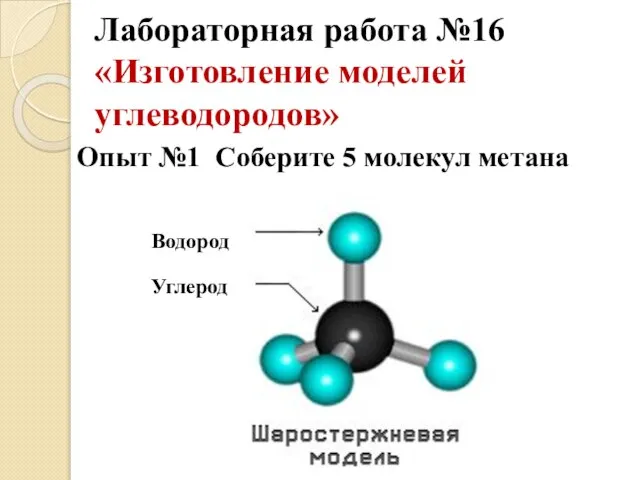
- 9. Лабораторная работа №16 «Изготовление моделей углеводородов» Опыт №1 Соберите 5 молекул метана Углерод Водород
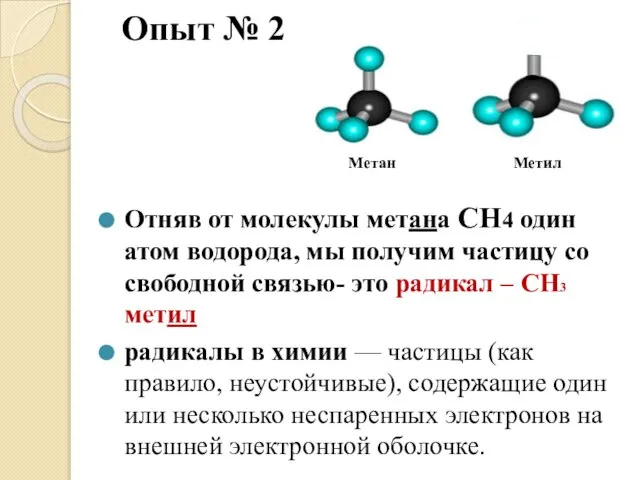
- 10. Опыт № 2 Отняв от молекулы метана СН4 один атом водорода, мы получим частицу со свободной
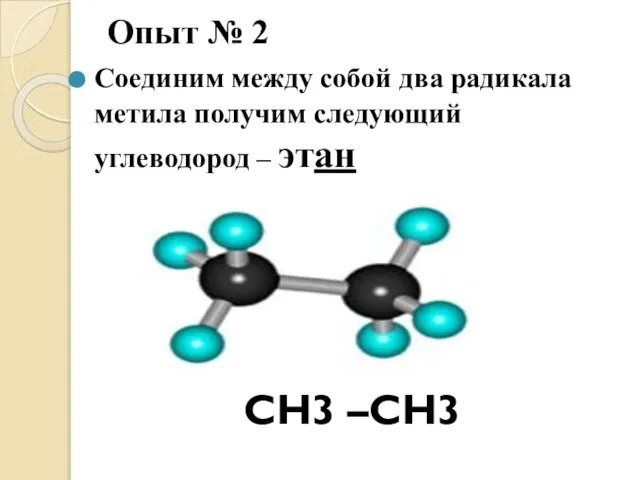
- 11. Опыт № 2 Соединим между собой два радикала метила получим следующий углеводород – этан СН3 –СН3
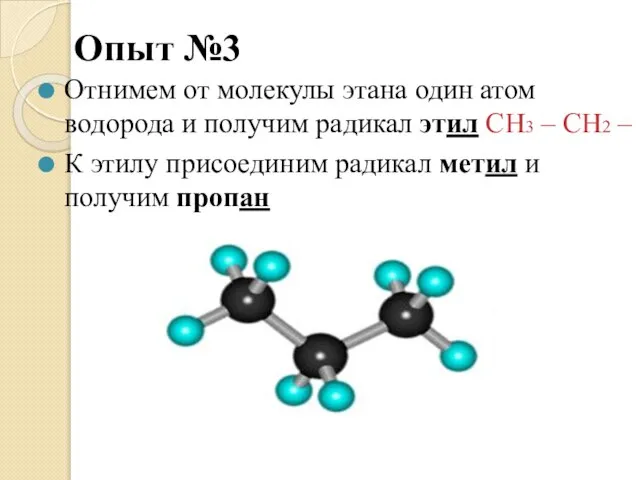
- 12. Опыт №3 Отнимем от молекулы этана один атом водорода и получим радикал этил СН3 – СН2
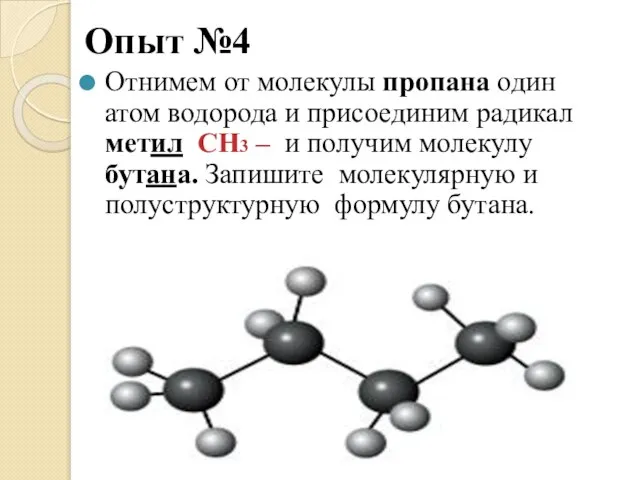
- 13. Опыт №4 Отнимем от молекулы пропана один атом водорода и присоединим радикал метил СН3 – и
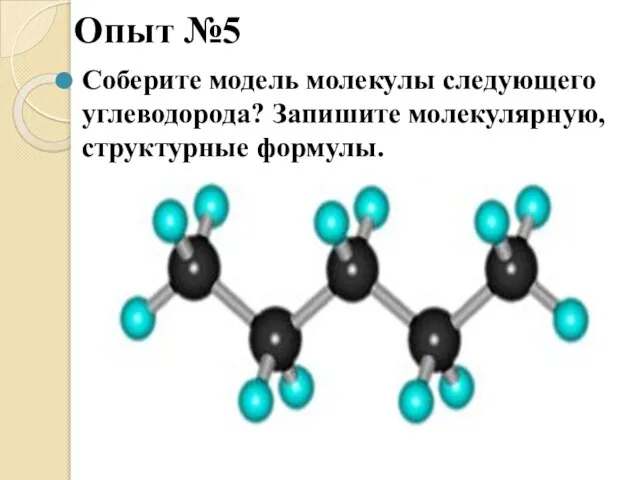
- 14. Опыт №5 Соберите модель молекулы следующего углеводорода? Запишите молекулярную, структурные формулы.
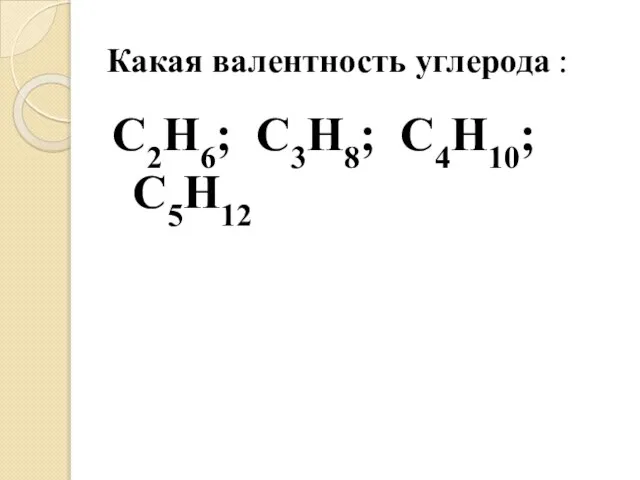
- 15. Какая валентность углерода : С2Н6; С3Н8; С4Н10; С5Н12
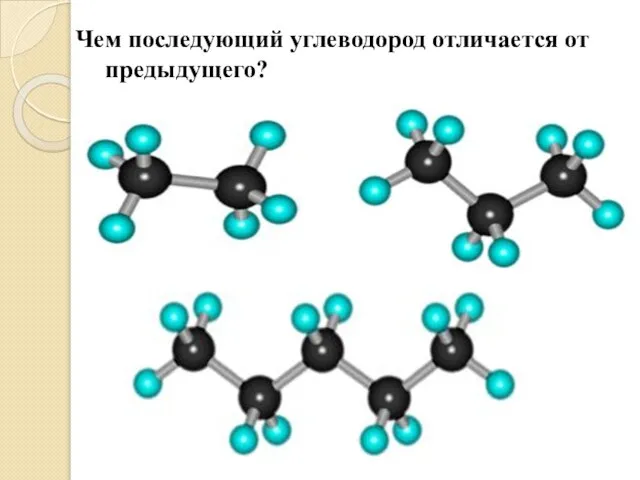
- 17. Чем последующий углеводород отличается от предыдущего?
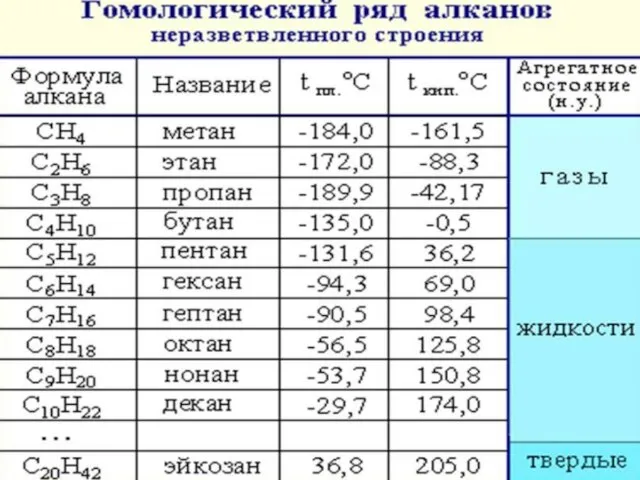
- 18. Гомологи– это вещества, сходные по строению и свойствам, но отличающиеся друг от друга по составу на
- 19. Углеводороды с общей формулой СпН2п+2 называются предельными углеводородами алканами. У этих веществ только простые одинарные связи
- 21. Применение углеводородов
- 22. В книге А. Азимова«Мир углерода» 1978 г. - Известно 1.700.000 органических веществ. 1995 г.- 10 млн.
- 23. Основные положения теории строения органических соединений А.М. Бутлерова Атомы в молекулах соединены в определенной последовательности, соответствии
- 24. Александр Михайлович Бутлеров Русский химик, родился в Татарстане Алексеевском районе 1828г. Профессор химии Казанского университета (1857-1868).
- 25. Проверим полученные знания. 1) Гомологом метана является углеводород: А) С2Н4 Б) С3Н8 В) С4Н8 Г) С2Н2
- 26. Домашнее задание Сообщение. Где и в каком виде предельные углеводороды встречаются в природе? Стр148-151прочитать,выучить формулы алканов,
- 27. "Химия - это область чудес, в ней скрыто счастье человечества, величайшие завоевания разума будут сделаны именно
- 29. Скачать презентацию















 Презентация на тему Количество вещества. Молярная масса
Презентация на тему Количество вещества. Молярная масса  Свинец
Свинец Строение атома и ПСХЭ. Повторение 9 класс
Строение атома и ПСХЭ. Повторение 9 класс Применение алкинов
Применение алкинов Алкины, гомологический ряд алкинов. Электронное и пространственное строение алкинов на примере ацетилена (1)
Алкины, гомологический ряд алкинов. Электронное и пространственное строение алкинов на примере ацетилена (1) Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Реакции ионного обмена
Реакции ионного обмена Обобщение. Неметаллы
Обобщение. Неметаллы Презентация на тему pH жидкостей, необходимых для человека
Презентация на тему pH жидкостей, необходимых для человека  Химия и производство. Химическая промышленность
Химия и производство. Химическая промышленность Кислоты
Кислоты Оптические свойства веществ
Оптические свойства веществ 1399920
1399920 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химия на войне
Химия на войне Закон Авогадро. Молярный объём газов
Закон Авогадро. Молярный объём газов Графит (С)
Графит (С) Презентация на тему Алюминий и его соединения
Презентация на тему Алюминий и его соединения  Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи
Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи Азот. Физические свойства азота
Азот. Физические свойства азота Химия в игре. Проектная работа
Химия в игре. Проектная работа Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Спирты
Спирты Изомерия
Изомерия Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот
Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот