Содержание
- 2. Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных
- 3. По некоторым другим сведениям, аммиак мог получить современное название от древнеегипетского слова «амониан». Так называли всех
- 4. Сокращенное название «аммиак» которым мы всегда пользуемся, ввел в обиход в 1801 году русский ученый -
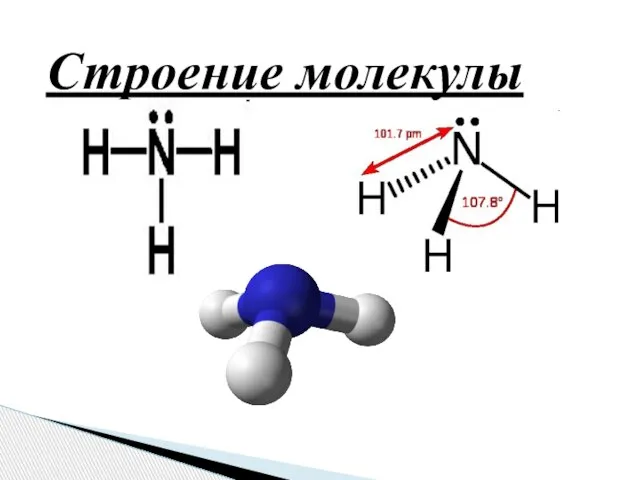
- 5. Строение молекулы
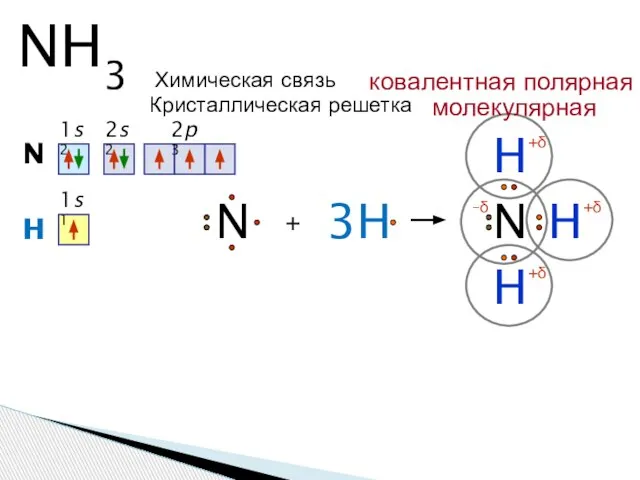
- 6. NH3 N 1s2 2s2 2p3 + H N H H 3H H N 1s1 +δ +δ
- 7. Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота
- 8. Физические свойства (при н.у. ) бесцветный газ с резким характерным запахом (запах нашатырного спирта) легче воздуха
- 9. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных вызвать токсический
- 10. Получение аммиака Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: 2NH4Cl +
- 11. Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г)
- 12. Химические свойства аммиака Для аммиака характерны реакции: 1) с изменением степени окисления атома азота (реакции окисления);
- 13. Реакции с изменением степени окисления атома азота (реакции окисления) N-3 → N0→ N+2 NH3-сильный восстановитель
- 14. с кислородом Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 Каталитическое окисление амииака
- 15. с оксидами металлов 2NH3 +3CuO =3Cu + N2 +3H2O
- 16. с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
- 17. Реакции без изменения степени окисления атома азота (присоединение - образование иона аммония NH4+ по донорно-акцепторному механизму
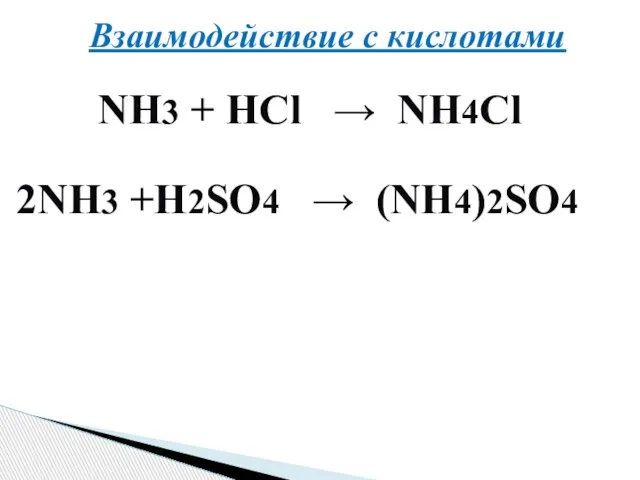
- 18. Взаимодействие с кислотами NH3 + HCl → NH4Cl 2NH3 +H2SO4 → (NH4)2SO4
- 19. Взаимодействие с водой NH3 + H2O = NH4OH При добавлении фенолфталеина‑ раствор становится малиновым, так как
- 20. Применение аммиака Производство пластмасс и волокон 2. В составе моющих средств
- 21. 3. Производство азотных удобрений 4. В сельском хозяйстве
- 22. 5. Производство азотной кислоты 6. Получение взрывчатых веществ
- 23. 7. В медицине
- 24. По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100
- 26. Скачать презентацию



















 Ацетилен
Ацетилен Технология получения красного фосфора
Технология получения красного фосфора Кислоты. Классификация кислот
Кислоты. Классификация кислот Невидиме чорнило
Невидиме чорнило Экономическое значение инвазионных болезней в агропромышленном комплексе. Химиопрофилактика инвазионных болезней
Экономическое значение инвазионных болезней в агропромышленном комплексе. Химиопрофилактика инвазионных болезней Введение в биохимию
Введение в биохимию Факторы, влияющие на скорость химических реакций
Факторы, влияющие на скорость химических реакций Синтетический каучук
Синтетический каучук Полімери. Пінополістирол
Полімери. Пінополістирол Нуклеин қышқылдары
Нуклеин қышқылдары Кислоты. Классификация. Номенклатура
Кислоты. Классификация. Номенклатура Липиды. Классификация липидов
Липиды. Классификация липидов Номенклатура алканов разветвленного строения
Номенклатура алканов разветвленного строения Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона
Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона Характеристика кислорода и серы
Характеристика кислорода и серы Алюминийорганические соединения
Алюминийорганические соединения Хим_10_30_Производство_аммиака
Хим_10_30_Производство_аммиака Классификация аминокислот в зависимости от природы радикалов
Классификация аминокислот в зависимости от природы радикалов Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Синтетические и натуральные краски
Синтетические и натуральные краски Вещества простые и сложные
Вещества простые и сложные Свойства глюкозы
Свойства глюкозы Презентация на тему: Подгруппа азота
Презентация на тему: Подгруппа азота Небезпечні речовини
Небезпечні речовини Металл XXI века титан
Металл XXI века титан Презентация Лекция 1. Химическая термодинамика
Презентация Лекция 1. Химическая термодинамика Электролитическая диссоциация
Электролитическая диссоциация Свойства кальция и магния. Жёсткость воды. Лекция №7
Свойства кальция и магния. Жёсткость воды. Лекция №7