Содержание
- 2. Повторение изученного ранее Что такое атом? Что такое ион? Чем отличается ион от атома? Какие типы
- 3. Правила вычисления степени окисления (СО) элементов:
- 4. Определите степени окисления атомов химических элементов по формулам их соединений: H2S, O2, NH3, HNO3, Fe, K2Cr2O7
- 5. +1 -2 0 -3 +1 +1 +5 -2 H2S O2 NH3 HNO3 0 +1 +7 -2
- 6. Расставьте степени окисления элементов в реакциях. Сравните, как ведут себя степени окисления в процессе реакции. HCl
- 7. « Кто-то теряет, а кто-то находит.» Тема урока: «Окислительно-восстановительные реакции»
- 8. - 2 е- 2 H+1Cl-1 + Zn0 = Zn+2Cl2-1 + H20 Zn0 2 H+ Zn+2 H20
- 9. Окисление – процесс отдачи электронов. Восстановление – процесс присоединения электронов. Окислитель – элемент, принимающий электроны. Восстановитель
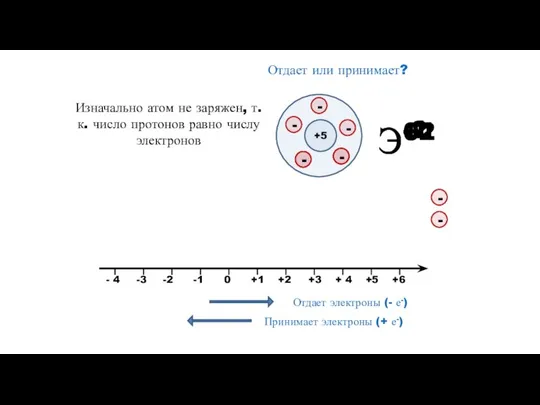
- 10. Э+1 Э+2 Э-2 Э-1 Отдает или принимает? +5 Изначально атом не заряжен, т.к. число протонов равно
- 11. Отдает или принимает? S+6 ? S0 S+6 ? S-2 Cu0 ? Cu+2 C0 ? C+4 +
- 12. Какая польза от теории ОВР? Например, расстановка коэффициентов в сложных уравнениях – метод электронного баланса HCl
- 13. План составления уравнений ОВР и электронного баланса к ним 1. Записать схему реакции. 2. Определить, атомы
- 14. Нитрат серебра + Медь= AgNO3 + Cu → Cu(NO3)2 + Ag↓ Карбонат кальция+соляная кислота= CaCO₃ +
- 15. AgNO3 + Cu → Cu(NO3)2 + Ag↓ Ag+1 +1 e Ag0 Cu0 - 2 e Cu+2
- 16. Расставьте коэффициенты методом электронного баланса
- 17. ОВР в быту
- 18. Газ метан горит бесцветным пламенем с образованием воды и углекислого газа СН4+2О2=СО2+2Н2О Горение газа на кухне
- 19. При обработке персолью отбеливание происходит за счет окисления загрязнений 2H2O2=2H2O+O2. Для того чтобы образующийся кислород не
- 20. При взаимодействии железа и кислорода образуется ржавчина. 4Fe+ 2O2= 2Fe2O3 Коррозия металла
- 21. Мы часто сталкиваемся с окислительно-восстановительными реакциями в быту: при горении газа; при коррозии металлов; при отбеливании
- 22. Задание №3 Выполните, работая в группе 1. Из приведенных схем уравнений реакций выпишите те, которые можно
- 23. Выполните проверку KMnO4 > K2 MnО4 + MnО2 + О2 О-2 Восстановитель CuS + О2 =>
- 25. Скачать презентацию





















 Презентация на тему Угарный газ
Презентация на тему Угарный газ  Азотная кислота
Азотная кислота Диффузия в газах, жидкостях и твердых телах
Диффузия в газах, жидкостях и твердых телах Фестиваль песчаных скульптур
Фестиваль песчаных скульптур Тема урока «Ионная связь»
Тема урока «Ионная связь» Классы неорганических соединений
Классы неорганических соединений Теория-кинетика
Теория-кинетика Основы химии полимеров
Основы химии полимеров Земная спираль Шанкуртуа
Земная спираль Шанкуртуа Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом
Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом Природный газ
Природный газ Арены. 10 класс
Арены. 10 класс Электронная структура атомов
Электронная структура атомов Вспомни… СаО, SО2, Fе2О3 , Nа2О, Сl2О7
Вспомни… СаО, SО2, Fе2О3 , Nа2О, Сl2О7 Бикомпонентные покрытия
Бикомпонентные покрытия Классификация органических веществ
Классификация органических веществ Металлом называется светлое тело, которое ковать можно
Металлом называется светлое тело, которое ковать можно Кислоты
Кислоты Стереоизомерия
Стереоизомерия Классификация химических реакций
Классификация химических реакций Амины. Номенклатура аминов
Амины. Номенклатура аминов Кислоты
Кислоты Свойства воды
Свойства воды Enantioselective Total Synthesis of (−)-Caldaphnidine O
Enantioselective Total Synthesis of (−)-Caldaphnidine O Карбид кальция. Назначение
Карбид кальция. Назначение Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Основные понятия химической кинетики. Скорость химической реакции
Основные понятия химической кинетики. Скорость химической реакции Галогены
Галогены