Слайд 2Цель урока:
углубить знания по теме «Растворы», обеспечить формирование понятий «Диффузия» и «Осмос»

на основе синтеза знаний студентов в химии, физике, биологии, технологии приготовления пищи;
Изучить законы Рауля и Вант - Гоффа
Слайд 3Между молекулами растворенного вещества большое расстояние и почти отсутствуют силы притяжения. Т.е.

поведение молекул в разбавленном растворе аналогично поведению идеального газа. Разбавленные растворы подчиняются законам идеальных газов, а свойства этих растворов не зависят от концентрации.
Слайд 4Диффузия
Диффузия –
процесс
самопроизвольного
выравнивания
концентраций
веществ в растворе.

Слайд 5Диффузия всегда идет из области с большей концентрации в сторону меньшей. При

этом энтропия (мера беспорядка) всегда увеличивается.
В газах скорость диффузии всегда меньше, что связано с большим расстоянием между молекулами и малой вязкостью растворов в газообразном агрегатном состоянии.
Слайд 6Диффузия играет важную роль в жизнедеятельности организмов, в природных и технологических процессах.

Примеры:1) перемещение питательных веществ и продуктов жизнедеятельности в организмах;
2) вымачивание соленой рыбы в воде или молоке;
3) заваривание чая выделяются экстрактивные вещества;
4) варка пищи - бульон насыщается разными компонентами.
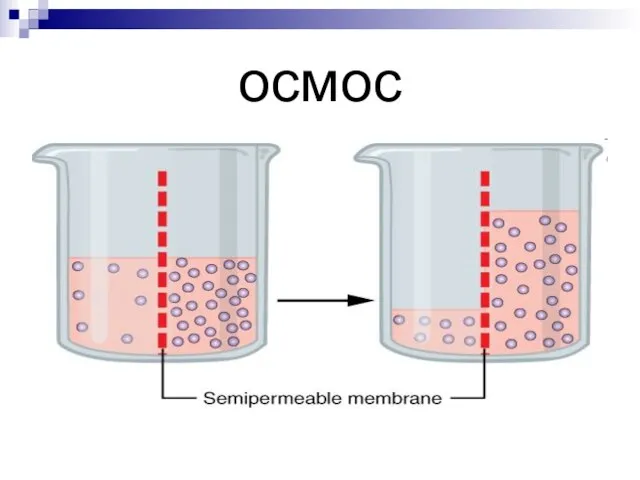
Слайд 9Осмос – явления перехода растворителя через полупроницаемую мембрану из области с меньшей

концентрацией в область с большей концентрацией
Слайд 11Значение осмоса
Велика роль осмоса в жизни растений, животных, в медицине и технологии.

Это и процесс усвоения пищи, обмен веществ, всасывание воды из почвы, внутривенные вливания, чувства жажды, консервирование пищевых продуктов и т.д.
Слайд 12Закон Вант - Гоффа
Сила, обуславливающая осмос, - осмотическое давление. Она равна тому

внешнему давлению, которое надо приложить к системе для прекращения осмоса.
Закон Вант-Гоффа для разбавленных растворов: осмотическое давление разбавленного раствора равно тому газовому давлению, которое производило бы растворенное вещество, если бы оно в виде газа при той же температуре занимало тот же объем, что и раствор.
Слайд 13Закон Вант - Гоффа
pV=nRT ↔ Росм = n/V*RT
Т.к. n/V=См ↔ Росм=

СмRT
Осмотическое давление прямо пропорционально концентрации раствора и абсолютной температуре.
Слайд 15Давление пара растворов.1 закон Рауля
Давление пара растворов.1 закон Рауля
Давление насыщенного пара жидкости

зависит от числа молекул, испаряющихся с её поверхности при данной температуре. Поверхность раствора состоит из молекул растворителя и растворённого вещества. Поэтому единица поверхности растворителя содержит большее количество молекул растворителя, чем единица поверхности раствора.
В единицу времени с поверхности растворителя испаряется большее число молекул, чем с поверхности раствора. Следовательно, при одной и той же температуре давление пара растворителя над раствором всегда ниже давления пара над чистым растворителем.
Слайд 16Первый закон Рауля
l-й закон Рауля: понижение давления пара растворителя над раствором при

постоянной температуре пропорционально молярной доле растворенного вещества.
Δ р = р*n / (n+N) (для разбавленных растворов и нелетучих растворенных веществ);
Где Δ р – понижение давления пара; р – давление пара растворителя над чистым растворителем; n – число молей растворённого вещества; N – число молей растворителя.
Слайд 17Второй закон Рауля
Из физики вы знаете, что жидкость закипает при такой температуре,

при котором давление ее насыщенного пара равно внешнему давлению. Поскольку верхний слой молекул в чистом растворителе однороден, давление пара над ним быстрее сравняется с внешним давлением, Т.е. растворитель всегда кипит при меньшей температуре, чем раствор.
Слайд 18Второй закон Рауля
Замерзает же жидкость при той температуре, при которой давление пара

вещества в твердом состоянии равно давлению пара этого вещества в жидком состоянии. (для воды это 00С). Раствор же всегда будет замерзать при более низкой температуре. Речная вода начинает замерзать при 00С, а морская при -2,50С.















 Презентация на тему Знаки химических элементов
Презентация на тему Знаки химических элементов  Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе Деформация аморфных и кристаллических полимеров
Деформация аморфных и кристаллических полимеров Увлекательный мир науки и практики
Увлекательный мир науки и практики Теоретические основы метода потенциалов самопроизвольной поляризации - ПС
Теоретические основы метода потенциалов самопроизвольной поляризации - ПС 1.2. Измерения веществ
1.2. Измерения веществ Презентация на тему Нефть и способы ее переработки
Презентация на тему Нефть и способы ее переработки  Основания. Как называют основания?
Основания. Как называют основания? Основной государственный экзамен Химия 2021
Основной государственный экзамен Химия 2021 Оксиды и гидроксиды металлов
Оксиды и гидроксиды металлов Предельные одноатомные спирты
Предельные одноатомные спирты Химические свойства оксидов
Химические свойства оксидов Белки
Белки Рефолдинг миниантител
Рефолдинг миниантител Презентация по Химии "Строении атомов. Химическая связь"
Презентация по Химии "Строении атомов. Химическая связь"  Классификация нефтей. Основы переработки нефти и нефтепродуктов
Классификация нефтей. Основы переработки нефти и нефтепродуктов Азотосодержащие соединения: Амины. Аминокислоты. Белки
Азотосодержащие соединения: Амины. Аминокислоты. Белки Металлы. Тест с ответами
Металлы. Тест с ответами Степени окисления
Степени окисления Ковалентная связь
Ковалентная связь Химические реакции
Химические реакции Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году
Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году Алкины. Ацетилен
Алкины. Ацетилен Зависимость знака заряда белка от pH
Зависимость знака заряда белка от pH Коррозия металлов
Коррозия металлов Химическая связь и строение молекул
Химическая связь и строение молекул Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС
Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС