Содержание
- 2. Положение серы в ПСХЭ
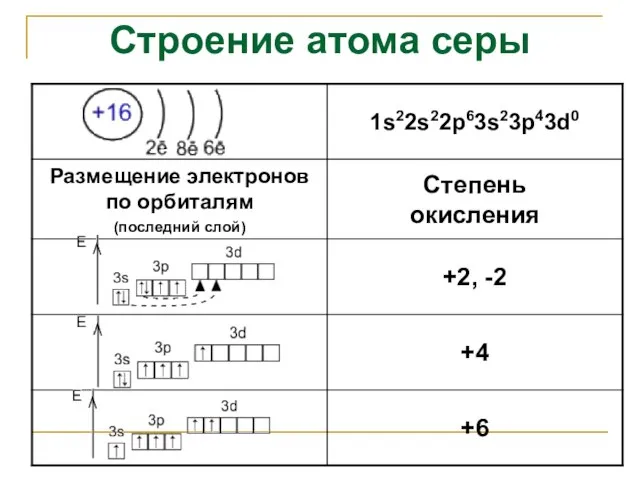
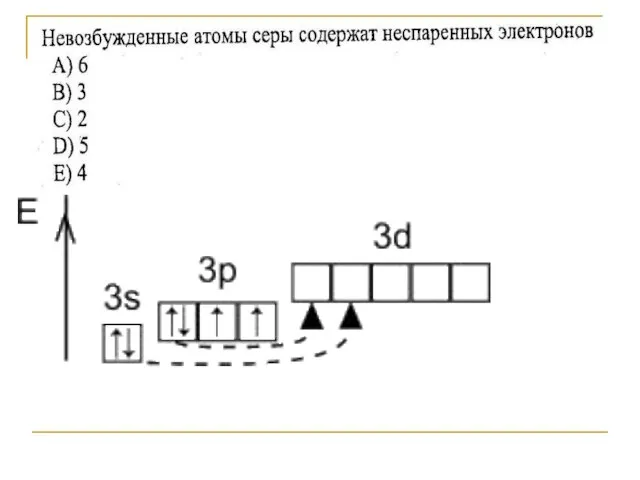
- 3. Строение атома серы
- 4. Окислительно-восстановительные свойства S-2 ⇄ S0 ⇄ S+4 ⇄ S+6 S-2 → только восстановители S0 → окислители,
- 5. *В свободном виде (самородная сера). *В виде соединений: органических и неорганических (сульфиды и сульфаты). *В составе
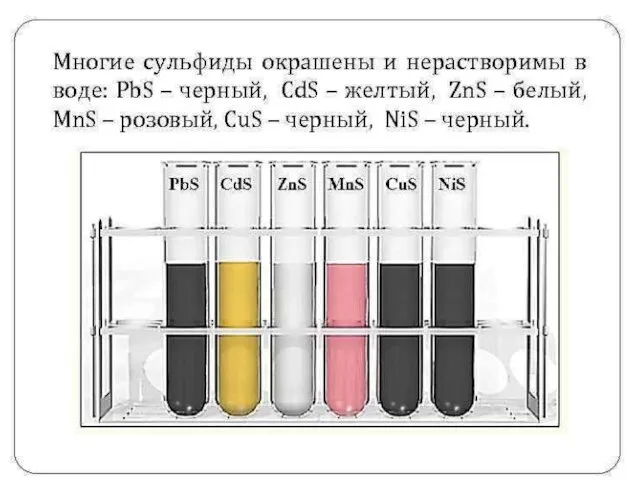
- 6. Самородная сера, серный колчедан FeS2, медный колчедан CuFeS2, свинцовый блеск PbS с цинковой обманкой ZnS (Балхаш
- 7. Физические свойства серы Агрегатное состояние ТВЕРДОЕ КРИСТАЛЛИЧЕСКОЕ Цвет ЖЕЛТЫЙ Запах БЕЗ ЗАПАХА Растворимость в воде НЕ
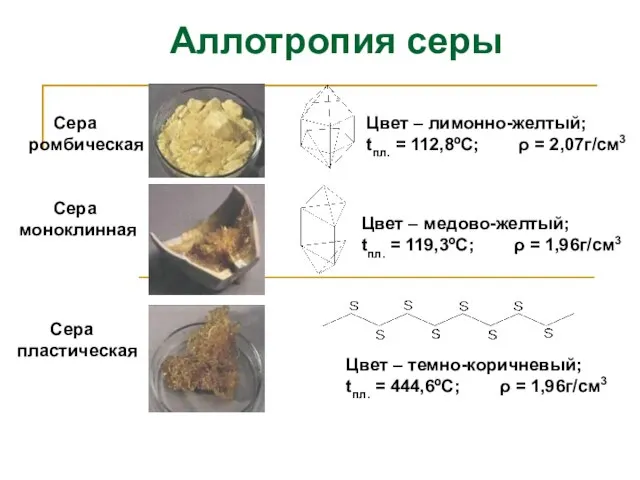
- 8. Сера ромбическая Сера пластическая Сера моноклинная Цвет – лимонно-желтый; tпл. = 112,8ºС; ρ = 2,07г/см3 Цвет
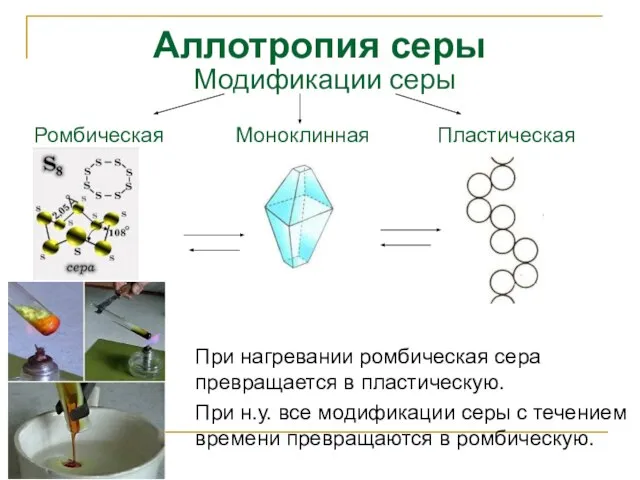
- 9. Аллотропия серы При нагревании ромбическая сера превращается в пластическую. При н.у. все модификации серы с течением
- 10. Реагирует с неметаллами (искл. азот N2 и иод I2): S + O2 = SO2 оксид серы
- 11. Реагирует с металлами (искл. золото Аu, платина Рt): 2Na + S = Na2S – сульфид натрия
- 12. Реагирует со сложными веществами: S + 2H2SO4(конц.) = 3SO2 + 2H2O S + 6HNO3(конц) = H2SO4
- 13. Получение серы 1. Неполное окисление сероводорода: 2H2S + O2 = 2S↓ + 2H2O (недостаток O2) 2.
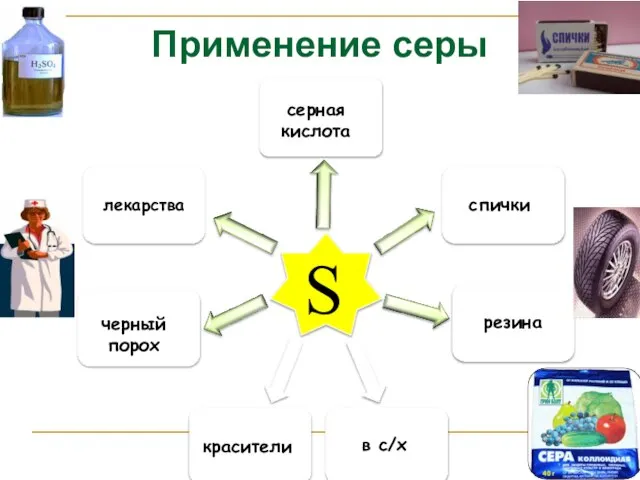
- 14. Применение серы
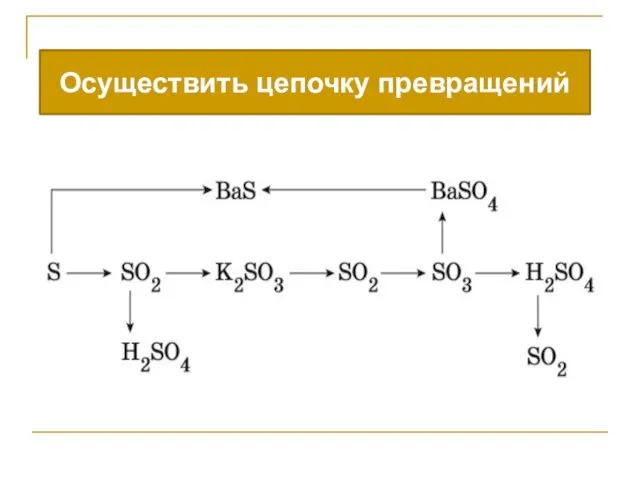
- 15. Осуществить цепочку превращений
- 16. Домашнее задание: П 10 упр 2,4,7,10 стр 47-48
- 17. Сероводород, cульфиды
- 18. Нахождение в природе Встречается в природе в вулканических газах, в месторождениях нефти и газа, в водах
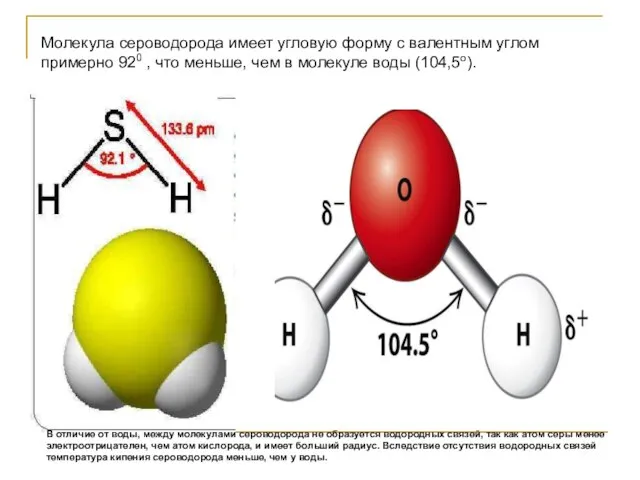
- 21. Молекула сероводорода имеет угловую форму с валентным углом примерно 920 , что меньше, чем в молекуле
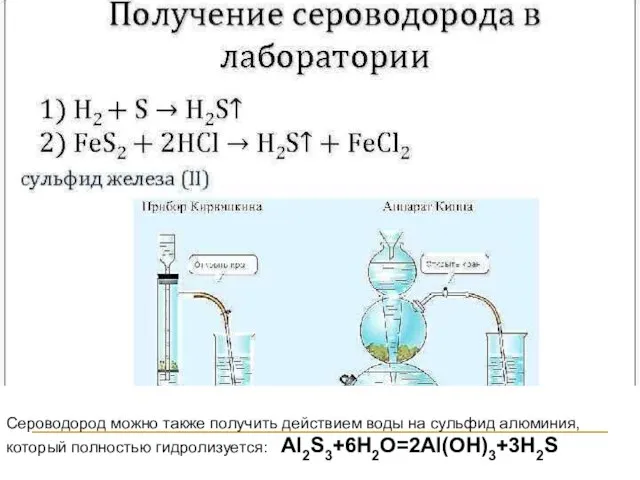
- 22. Сероводород можно также получить действием воды на сульфид алюминия, который полностью гидролизуется: Al2S3+6H2O=2Al(OH)3+3H2S
- 25. Сильные окислители, например водный раствор хлора (хлорная вода) и азотная кислота, способны окислить сероводород до серной
- 31. Домашнее задание п 11 упр 1,3,5,7 стр 52
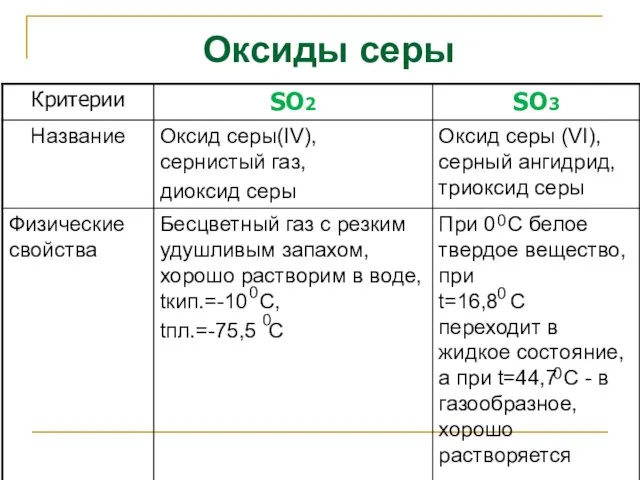
- 32. Оксиды серы
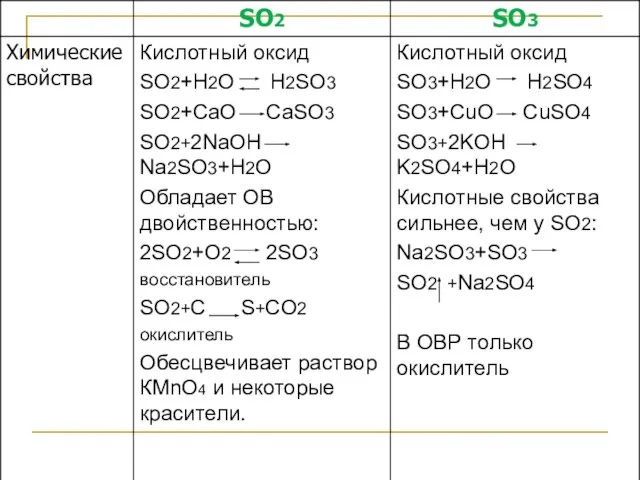
- 33. Оксиды серы 0 0 0 0 0
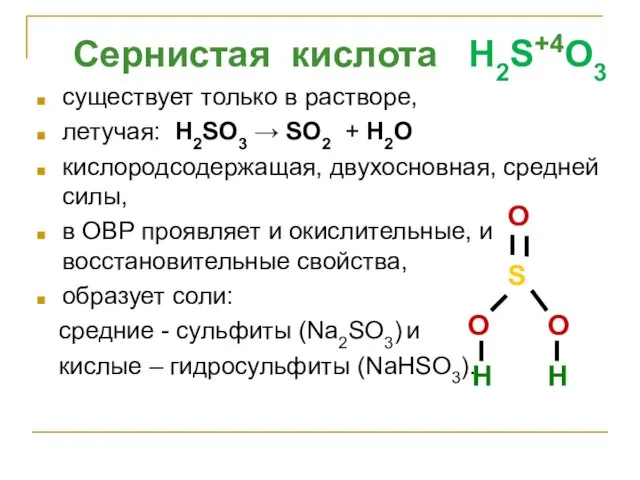
- 35. Сернистая кислота H2S+4O3 существует только в растворе, летучая: H2SO3 → SO2 + H2O кислородсодержащая, двухосновная, средней
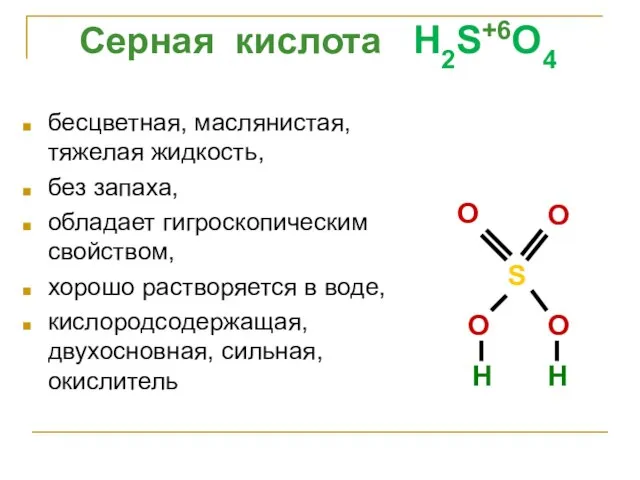
- 36. бесцветная, маслянистая, тяжелая жидкость, без запаха, обладает гигроскопическим свойством, хорошо растворяется в воде, кислородсодержащая, двухосновная, сильная,
- 37. S, H2S, FeS2 → SO2 → SO3 → H2SO4 1-я стадия. Печь для обжига колчедана. Получение
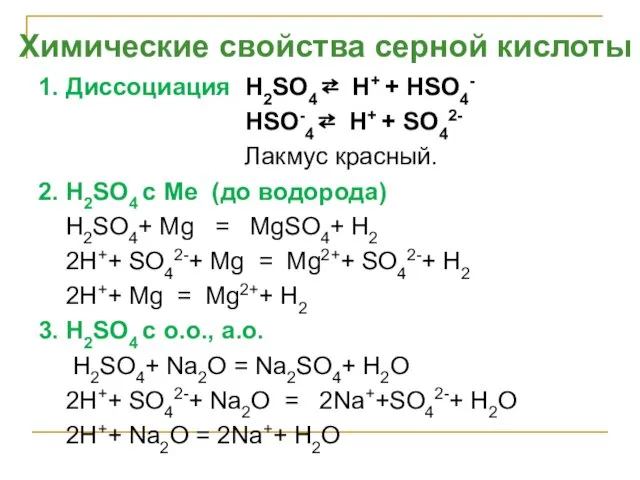
- 38. 1. Диссоциация H2SO4 ⇄ H+ + НSO4- HSO-4 ⇄ H+ + SO42- Лакмус красный. 2. H2SO4
- 39. 4. H2SO4 с основаниями H2SO4+2NaOH = Na2 SO4+ 2H2O 2H+ + SO42-+ 2Na+ + 2OH- =2Na++SO42-+
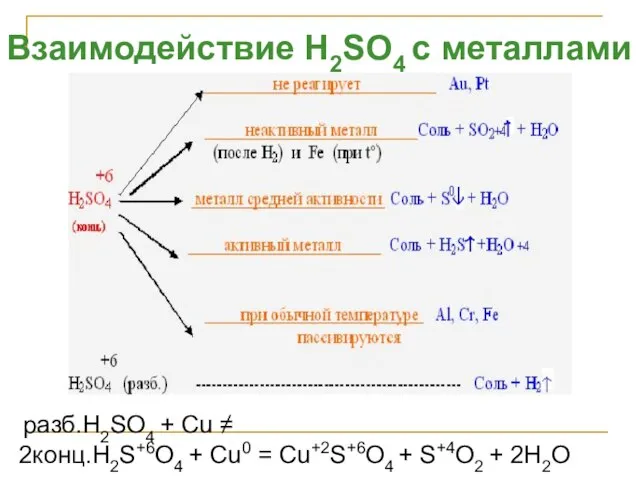
- 40. Взаимодействие H2SO4 с металлами разб.H2SO4 + Cu ≠ 2конц.H2S+6O4 + Cu0 = Cu+2S+6O4 + S+4O2 +
- 41. C12H22O11(сахароза)+H2SO4 →12С(уголь) +H2SO4 *11H2O Органические вещества обугливаются !!! C + 2H2SO4 = CO2 + 2SO2 +
- 42. Применение серной кислоты - в производстве минеральных удобрений; - как электролит в свинцовых аккумуляторах; - в
- 44. Сумма всех электронов (SO3)= 16+8*3= 40 Сумма всех электронов (Н2SO4)= 1*2+16+8*4= 50
- 46. S+ Ме S+ НеМе S в воде не растворяется, не смачивается
- 47. S-2 → только восстановители S0 → окислители, восстановители S+4 → окислители, восстановители S+6 → только окислители
- 49. H2SO4 ⇄ H+ + НSO4- гидросульфат-ион HSO-4 ⇄ H+ + SO42- сульфат-ион Соли: гидросульфаты, сульфаты.
- 50. Са(ОН)2 ⇄ СаОН+ + ОН- 2Са(ОН)2 + Н2SО4 = (СаОН)2SО4 + 2Н2О 2 + 1+ 1
- 51. Серная кислота реагирует с металлами (до Н), основными и амфотерными оксидами, основаниями. Ответ: А.
- 52. 2H2SO4 + Cu = CuSO4 + SO2 + 2H2O Сумма коэффициентов 2 + 1 + 1
- 54. Обжиг пирита 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q
- 55. гипс CaSO4∙2H2O
- 56. Н2S → SО2 → SО3 → Н2SО4 → SО2
- 59. Скачать презентацию








































 Prezentatsia_Microsoft_PowerPoint (1)
Prezentatsia_Microsoft_PowerPoint (1) 12 принципов зелёной химии
12 принципов зелёной химии Определение содержание фосфатов в воде фотометрическим методом
Определение содержание фосфатов в воде фотометрическим методом Презентация на тему Свойства черных и цветных металлов
Презентация на тему Свойства черных и цветных металлов  Кинетическое лимитирование роста и жизненные стратегии микроорганизмов
Кинетическое лимитирование роста и жизненные стратегии микроорганизмов Липиды
Липиды Кремний Полупроводники в электронике_Горб
Кремний Полупроводники в электронике_Горб Неметаллы. Особенности электронного строения атомов НМ
Неметаллы. Особенности электронного строения атомов НМ Лекарственные растения содержащие флавоноиды
Лекарственные растения содержащие флавоноиды ОВР в гетерогенных системах
ОВР в гетерогенных системах Общая характеристика МЕТАЛЛОВ
Общая характеристика МЕТАЛЛОВ Изучение процесса замерзания воды
Изучение процесса замерзания воды Взаимодействие кислот с металлами. Кислоты-окислители
Взаимодействие кислот с металлами. Кислоты-окислители 7609f31d31514fe19b6df19a98197139 (1)
7609f31d31514fe19b6df19a98197139 (1) Сера
Сера Разработка методики расчета фазового равновесия при длительном хранении СПГ
Разработка методики расчета фазового равновесия при длительном хранении СПГ Алканы: строение, номенклатура, изомерия, физические свойства
Алканы: строение, номенклатура, изомерия, физические свойства 98675992
98675992 Ионо-дисперсное состояние микрокомпонентов в растворах
Ионо-дисперсное состояние микрокомпонентов в растворах Алкены. Олефины, этиленовые углеводороды. (Лекция 5)
Алкены. Олефины, этиленовые углеводороды. (Лекция 5) Metals Properties and compounds
Metals Properties and compounds Исследование интерактивной компьютерной химической модели
Исследование интерактивной компьютерной химической модели Алканы
Алканы Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии
Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии Экологические характеристики ДВС
Экологические характеристики ДВС Гетерогенные химические системы и поверхностные явления в них
Гетерогенные химические системы и поверхностные явления в них Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры)
Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры) Презентация на тему Применение солей
Презентация на тему Применение солей