Слайд 3Знаете ли вы, что…
Все растения Земли в течение года создают около

3 триллионов тонн кислорода
Слайд 4Знаете ли вы, что…
Люди вдыхают более 6 млрд. тонн кислорода в год.

Слайд 5Знаете ли вы, что…
Кислород отвечает за ярко-красный и желто-зеленый цвета радуги.

Слайд 6Знаете ли вы, что…
Около 2/3 человеческого тела содержит кислород, и клетки
тела не могут существовать без него.
Слайд 7Знаете ли вы, что…
Человек, как биологический вид, сформировался, когда концентрация кислорода в

атмосфере Земли достигла 38-40%
Слайд 8Знаете ли вы, что…
За сутки здоровый человек в спокойном состоянии прокачивает

через легкие 7200л воздуха, безвозвратно забирая из атмосферы около 1500 л кислорода.
Слайд 9С чем мы должны сегодня познакомиться?
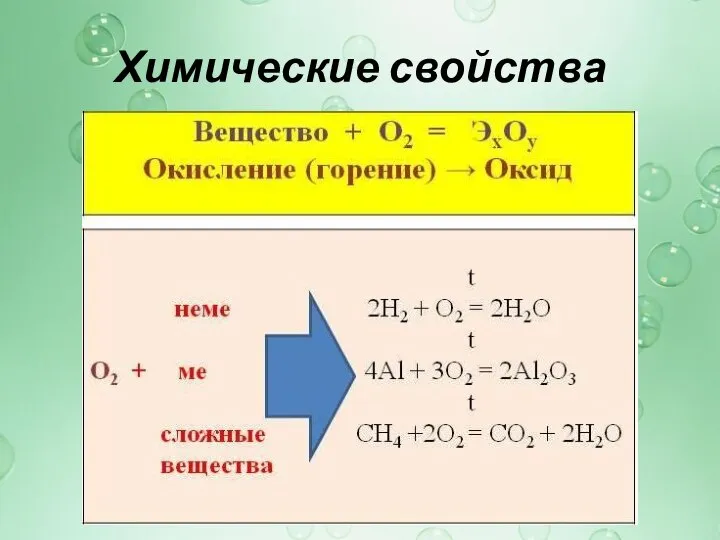
Кислород как химический элемент
Кислород в природе
Кислород –

простое вещество (физические свойства кислорода)
Химические свойства кислорода
Получение кислорода
Открытие кислорода
Применение кислорода
Слайд 10Кислород как химический элемент
Порядковый номер -
8
Группа –
VI А
Период

–
2
Электронная формула
1s22s22p4
Степени окисления:
-2,-1, 0, +2
Слайд 11Кислород в природе
Атмосфера – 21 %
Гидросфера – 89%
Земная кора – 49%
Живые организмы

- 65%
Слайд 12Кислород – простое вещество
Газ без цвета, вкуса и запаха, немного тяжелее воздуха
Жидкий кислород (температура

кипения −182,98 °C) — это бледно-голубая жидкость.
Слайд 19Закончите уравнения реакций, расставьте коэффициенты
Ca + ? = СаО
? + О2 =

Al2O3
Li + O2 = ?
S + ? = SO2
? + O2 = NO
P + O2 = ?
Слайд 20Получение кислорода в лаборатории
Разложение перманганата калия
2KMnO4 ? K2MnO4 + MnO2 +

O2
Разложение пероксида водорода
2H2O2 ? 2H2O + O2
Разложение хлората калия
2KClO3 ? 2KCl + 3O2
Разложение оксида ртути (II)
2HgO ? 2Hg + O2
Электролиз воды
2H2O ? 2 H2 + O2
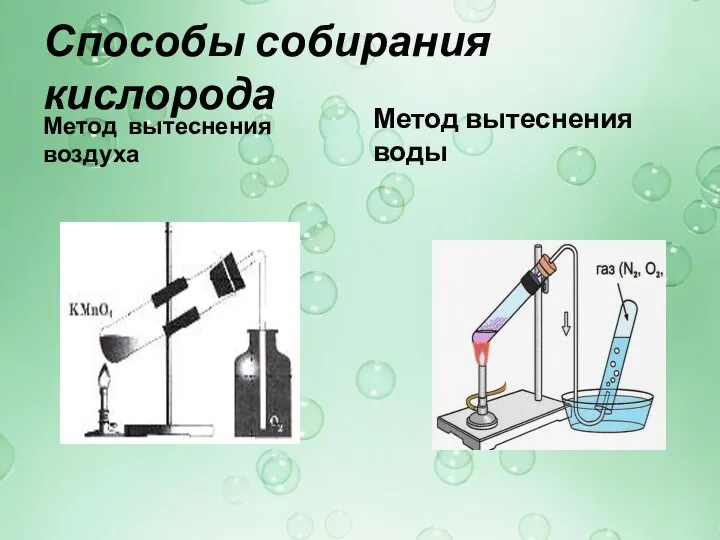
Слайд 22Способы собирания кислорода
Метод вытеснения воздуха
Метод вытеснения воды
Слайд 23Открытие кислорода
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774

года путём разложения оксида ртути
Слайд 24Открытие кислорода
Несколькими годами ранее кислород получил шведский химик Карл Шееле при прокаливании селитры.

Он назвал этот газ «огненным воздухом» (1772 г.).
Слайд 25Открытие кислорода
Окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от

Пристли и Шееле (1778 г.), который назвал его oxygenium - т.е. «рождающий кислоты», или «кислород».
Слайд 27Но главными потребителями кислорода являются энергетика, металлургия и химическая промышленность

Слайд 28В машиностроении, в строительстве кислород используют для сварки и резки металлов.

Слайд 29Домашнее задание:
§25, задание на карточке




























 Типы кристаллических решёток
Типы кристаллических решёток Таблица Менделеева
Таблица Менделеева Химическая идентификация основных классов биомолекул
Химическая идентификация основных классов биомолекул Соль - без вины виновата
Соль - без вины виновата Вязкоупругие свойства полимеров
Вязкоупругие свойства полимеров Ориентация полимеров
Ориентация полимеров Массовая доля вещества в растворе
Массовая доля вещества в растворе Очистка хозяйственных и сточных вод от азота аммонийного с помощью нитрифицирующих бактерий
Очистка хозяйственных и сточных вод от азота аммонийного с помощью нитрифицирующих бактерий Выберите вещества
Выберите вещества Основы квантовой химии
Основы квантовой химии Теория электролитической диссоциации
Теория электролитической диссоциации Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Химическая картина мира
Химическая картина мира Презентация на тему Величие гениального творчества великого соотечественника
Презентация на тему Величие гениального творчества великого соотечественника  Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга
Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга Закон сохранения массы и энергии
Закон сохранения массы и энергии Презентация на тему Альдегиды (10 класс)
Презентация на тему Альдегиды (10 класс)  Основные положения о строении вещества
Основные положения о строении вещества Круговорот серы в природе
Круговорот серы в природе Лекция 26. Химическое (водородное) и электрохимическое аккумулирование энергии
Лекция 26. Химическое (водородное) и электрохимическое аккумулирование энергии Презентация на тему Химический элемент - водород
Презентация на тему Химический элемент - водород  Химическая связь и строение молекул
Химическая связь и строение молекул Sinteticheskie_Materialy_I_Ikh_Rol_1
Sinteticheskie_Materialy_I_Ikh_Rol_1 Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Бензол (Арены )
Бензол (Арены ) Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Волокна
Волокна Задача №8: Не тормози. Команда: Карбораны
Задача №8: Не тормози. Команда: Карбораны