Содержание
- 2. CnH2n+2 Химическая устойчивость алканов объясняется высокой прочностью б - связей С-С и С-Н, а также их
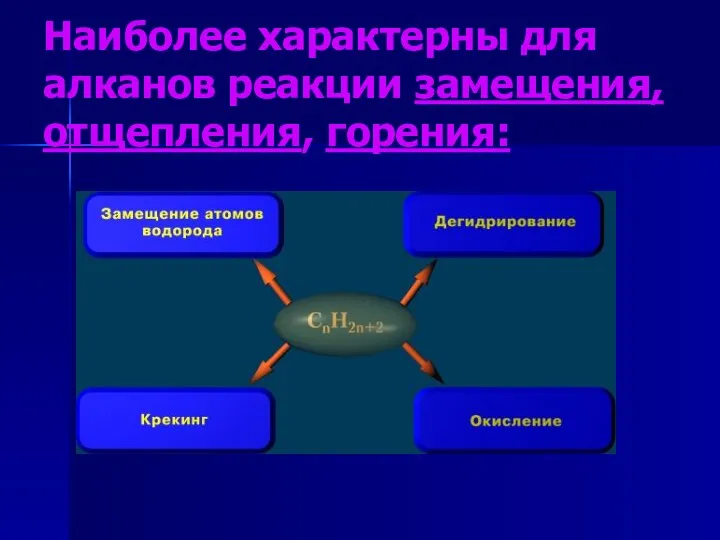
- 3. Наиболее характерны для алканов реакции замещения, отщепления, горения:
- 4. Реакции замещения. Протекают по механизму радикального замещения, обозначаемого Sr (англ. substitution radicalic). а) с галогенами (с
- 5. Механизм реакции замещения Состоит из 3 стадий: -зарождение цепи Cl2 2Cl· -развитие цепи CH4 + Cl·
- 6. Общая схема реакции Sr * Замещение у хлорметана идет легче, чем у метана, так как атом
- 7. Взаимодействие со фтором в) в атмосфере фтора происходит следующая реакция:
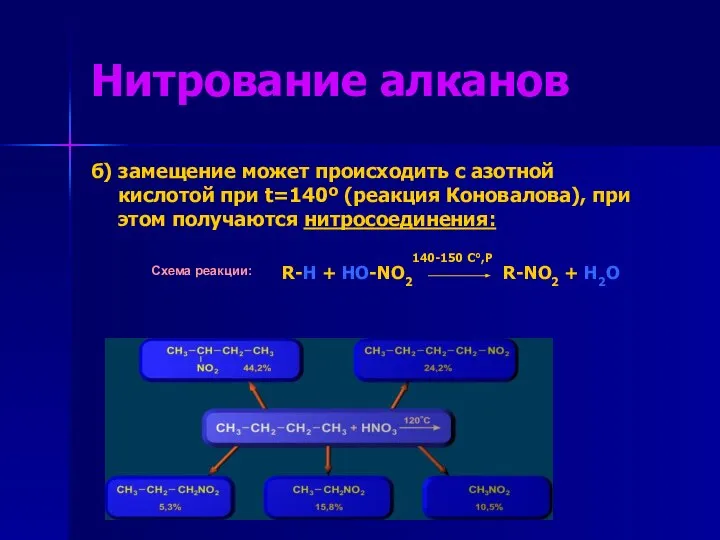
- 8. Нитрование алканов б) замещение может происходить с азотной кислотой при t=140º (реакция Коновалова), при этом получаются
- 9. Реакции отщепления. а) дегидрирование: CH3 – CH3 Pt,t° CH2=CH2 + H2 б) крекинг алканов: CH3 –
- 10. Крекинг алканов Крекинг – реакции расщепления углеродного скелета крупных молекул при нагревании и в присутствии катализаторов.
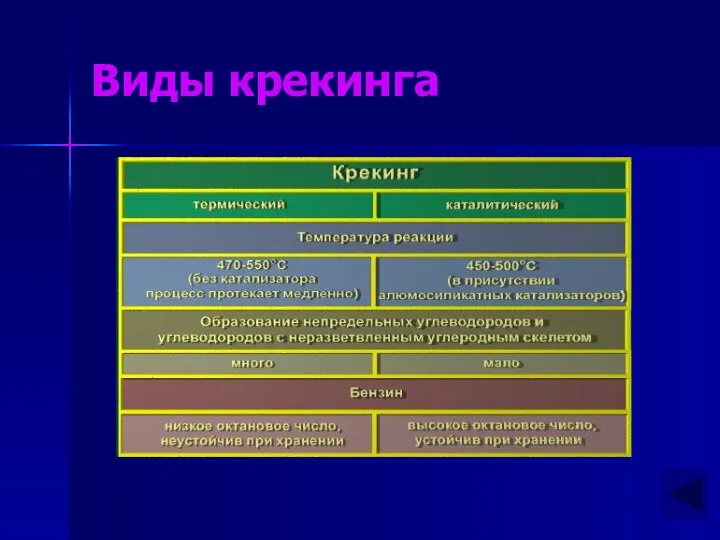
- 11. Виды крекинга
- 12. Реакции окисления. а) все алканы горят с образованием углекислого газа и воды : * б) при
- 13. Реакции изомеризации. Алканы подвергаются изомеризации при нагревании на катализаторе AlCl3 :
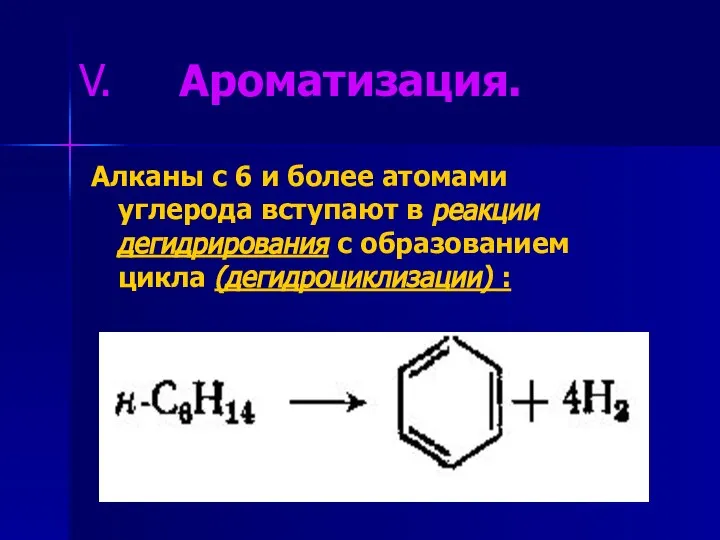
- 14. Ароматизация. Алканы с 6 и более атомами углерода вступают в реакции дегидрирования с образованием цикла (дегидроциклизации)
- 16. Скачать презентацию









 Серная кислота и для чего используется
Серная кислота и для чего используется Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Основной государственный экзамен. Химия 2022. Задание 2
Основной государственный экзамен. Химия 2022. Задание 2 Номенклатура и изомерия алкенов
Номенклатура и изомерия алкенов Применение брома
Применение брома Валентность (от латинского valentia – сила)
Валентность (от латинского valentia – сила) Изомерия и ее виды
Изомерия и ее виды Бордос сұйықтығын дайындау және оның сапасын тексеру
Бордос сұйықтығын дайындау және оның сапасын тексеру Химические реакции в органической химии
Химические реакции в органической химии Чистые вещества и смеси. Использование химического анализа
Чистые вещества и смеси. Использование химического анализа Кислородные соединения азота. Оксиды. Кислоты. Соли
Кислородные соединения азота. Оксиды. Кислоты. Соли Презентация на тему Драгоценные камни
Презентация на тему Драгоценные камни  Карбонильные соединения – альдегиды
Карбонильные соединения – альдегиды Буферные системы
Буферные системы Вещество. Свойства веществ
Вещество. Свойства веществ Понятие аналитической химии, её цели и задачи. Химический анализ, его задачи
Понятие аналитической химии, её цели и задачи. Химический анализ, его задачи Ниобий. Химические свойства
Ниобий. Химические свойства Химические элементы, входящие в состав питательных веществ
Химические элементы, входящие в состав питательных веществ Алканы. Химические свойства, получение и особенности
Алканы. Химические свойства, получение и особенности Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Ксантановая камедь
Ксантановая камедь Окислительно-восстановительные реакции. ОГЭ по химии, задание 15
Окислительно-восстановительные реакции. ОГЭ по химии, задание 15 Составление формул солей
Составление формул солей О чем не узнаешь на уроке
О чем не узнаешь на уроке Очистка рабочих электродов
Очистка рабочих электродов Структура и свойства латуни. Изучение структуры латунного спая лемеха
Структура и свойства латуни. Изучение структуры латунного спая лемеха Повторение пройденного
Повторение пройденного Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН
Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН