Содержание
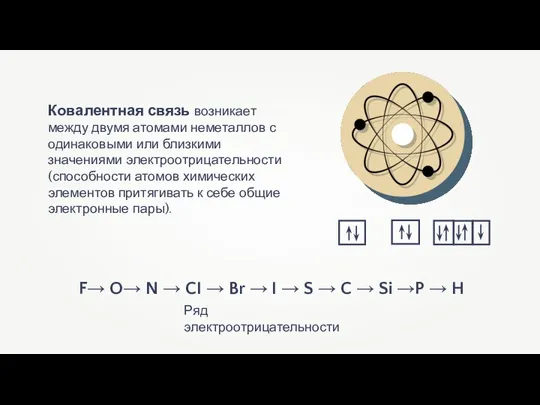
- 2. Ковалентная связь возникает между двумя атомами неметаллов с одинаковыми или близкими значениями электроотрицательности (способности атомов химических
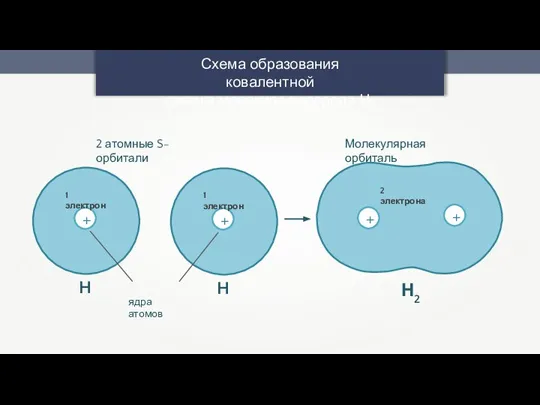
- 3. Схема образования ковалентной связи в молекуле водорода Н2 + 1 электрон H ядра атомов + 1
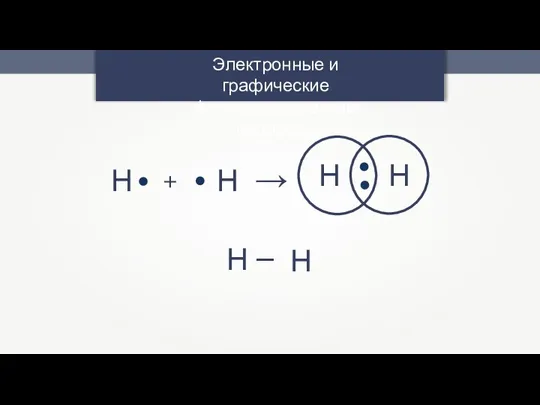
- 4. Электронные и графические формулы молекулы водорода Н + Н → Н Н Н — Н
- 5. Ковалентная химическая связь – химическая связь между атомами, которая осуществляется за счёт образования общих электронных пар.
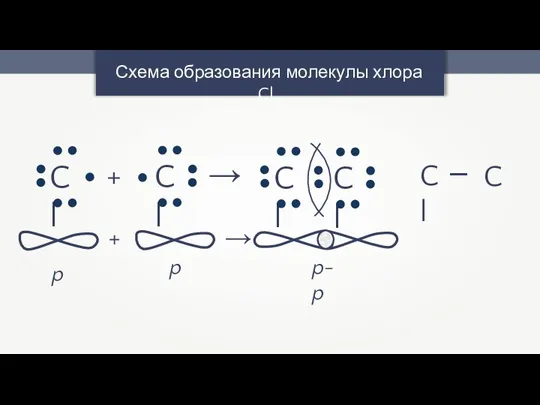
- 6. Схема образования молекулы хлора Cl2 + → Cl — C p p p-p + →
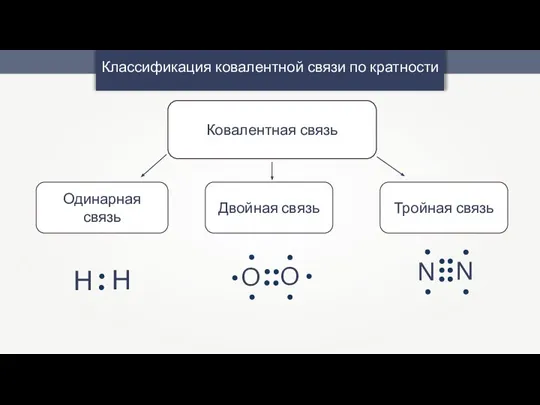
- 7. Классификация ковалентной связи по кратности Ковалентная связь
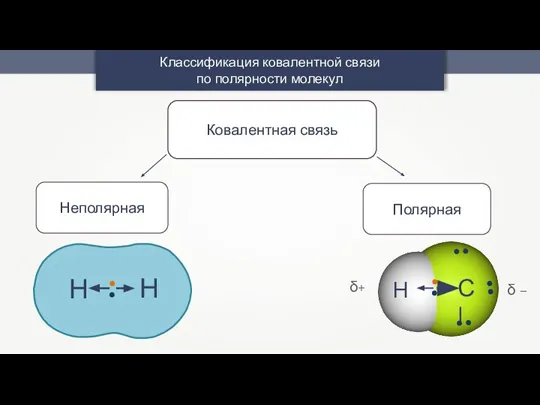
- 8. Классификация ковалентной связи по полярности молекул Ковалентная связь Сl H δ+ δ –
- 9. Диполь — молекула с двумя противоположно заряженными полюсами. – +
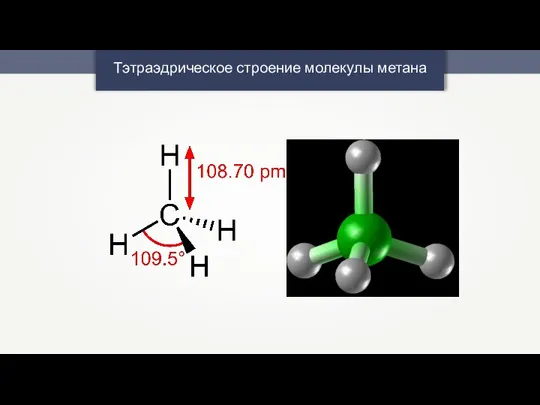
- 10. Тэтраэдрическое строение молекулы метана
- 11. Полярность молекулы зависит не только от полярности связей, но и от её геометрического строения.
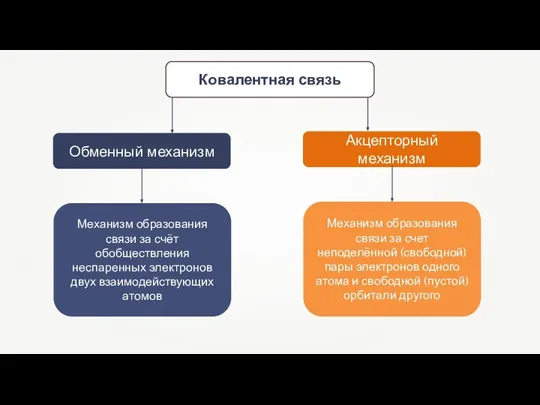
- 12. Обменный механизм Акцепторный механизм Механизм образования связи за счёт обобществления неспаренных электронов двух взаимодействующих атомов Механизм
- 13. Донорно-акцепторный механизм на примере образования иона аммония Полное молекулярное уравнение NH3 + HCl = NH4Cl Сокращённое
- 14. Донорно-акцепторный механизм на примере образования иона аммония Электронная схема взаимодействия Н Н Н N X X
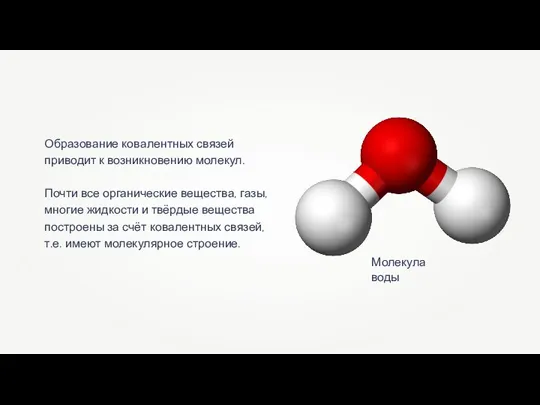
- 15. Образование ковалентных связей приводит к возникновению молекул. Почти все органические вещества, газы, многие жидкости и твёрдые
- 16. Молекулярная кристаллическая решетка Углекислый газ Йод
- 18. Скачать презентацию






 Винилпиридиновые каучуки
Винилпиридиновые каучуки Кислород O2
Кислород O2 Окислительно-восстановительные реакции. 8 класс
Окислительно-восстановительные реакции. 8 класс Презентация по Химии "Химия в сельском хозяйстве"
Презентация по Химии "Химия в сельском хозяйстве"  Фестиваль песчаных скульптур
Фестиваль песчаных скульптур Химия и жизнь
Химия и жизнь Термохимическое уравнение реакции полного сгорания ацетилена
Термохимическое уравнение реакции полного сгорания ацетилена Этиленгликоль
Этиленгликоль Презентация на тему Валентные состояния атома углерода
Презентация на тему Валентные состояния атома углерода  Исследовательская работа на тему: «Выращивание кристалла в домашних условиях» Работу выполнила ученица 10-а класса Алексеева О
Исследовательская работа на тему: «Выращивание кристалла в домашних условиях» Работу выполнила ученица 10-а класса Алексеева О Химическая кинетика. Основные понятия. Основы формальной кинетики
Химическая кинетика. Основные понятия. Основы формальной кинетики Технология растворов на неводных растворителях
Технология растворов на неводных растворителях Алкины: получение и свойства
Алкины: получение и свойства Трансляция. Активизирование аминокислоты
Трансляция. Активизирование аминокислоты Основные понятия и представления о химии. Тела и среды. Представление о системах
Основные понятия и представления о химии. Тела и среды. Представление о системах Подготовка к контрольной работе Неметаллы
Подготовка к контрольной работе Неметаллы Полезные ископаемые
Полезные ископаемые Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Презентация на тему Выбирай вопрос и отвечай
Презентация на тему Выбирай вопрос и отвечай  Алкины, гомологический ряд алкинов. Электронное и пространственное строение алкинов на примере ацетилена (1)
Алкины, гомологический ряд алкинов. Электронное и пространственное строение алкинов на примере ацетилена (1) Кремний. Германий, олово, свинец (Лекция № 6)
Кремний. Германий, олово, свинец (Лекция № 6) Коагуляция в дисперсных системах
Коагуляция в дисперсных системах Электролитическая диссоциация
Электролитическая диссоциация Получение этиленгликоля
Получение этиленгликоля Разработка системы подготовки лаборанта химического анализа
Разработка системы подготовки лаборанта химического анализа Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций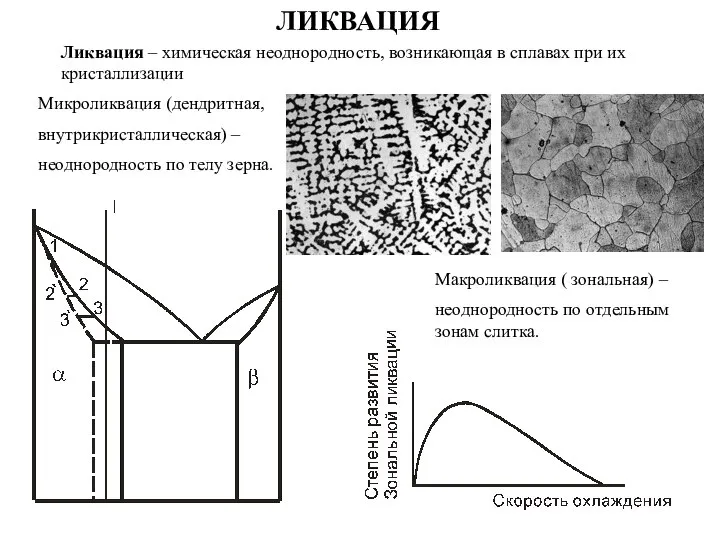 Ликвация – химическая неоднородность
Ликвация – химическая неоднородность Гидрометаллургическое обескремнивание титанового сырья соединениями фтора
Гидрометаллургическое обескремнивание титанового сырья соединениями фтора