Содержание
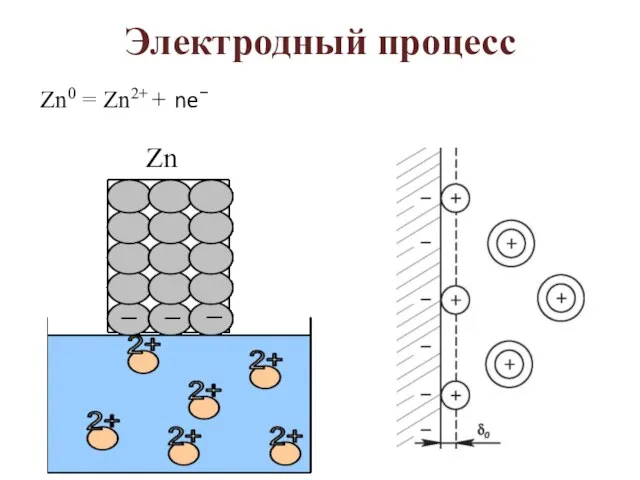
- 2. Электродный процесс Zn0 = Zn2+ + ne−
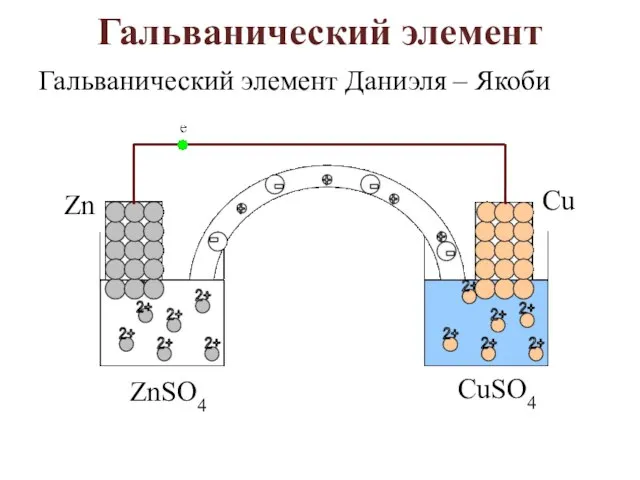
- 3. Гальванический элемент Гальванический элемент Даниэля – Якоби
- 4. Zn│ZnSO4││CuSO4│Cu. Zn – 2ē → Zn2+ – анодное окисление; Cu2+ + 2ē → Cu0 – катодное
- 5. Уравнение Нернста
- 6. Водородный электрод Схема: (Pt) H2⏐H+ Уравнение электродной реакции: H2 ⇄ 2Н+ + 2е– . Уравнение Нернста:
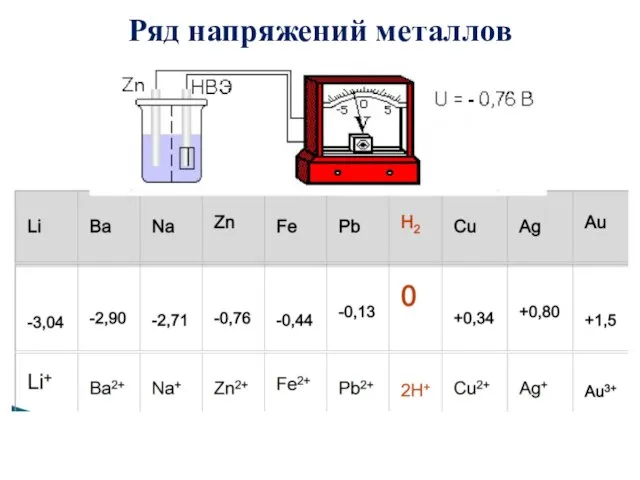
- 7. Ряд напряжений металлов
- 8. Классификация электродов: 1) По природе электродной реакции: I рода II рода Окислительно-восстановительные (RedOx) Ионоселективные (ионообменные) 2)
- 9. Электроды 1 рода Обратимы относительно катиона Схема: Меn+/ Mе0 (Ag, Zn, Cu, Cd) Электродный процесс: Mez+
- 10. Электроды II рода Обратимы относительно аниона Схема: Ме | МеAn | Anz─ Электродный процесс: МеAn +
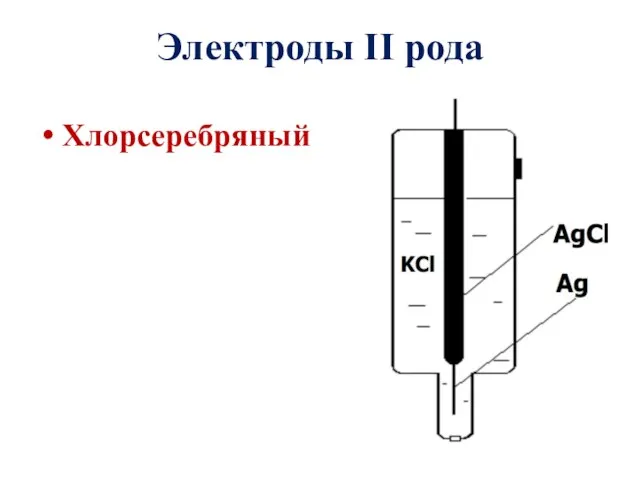
- 11. Хлорсеребряный Электроды II рода
- 12. Электроды II рода Хлорсеребряный электрод Схема: Аg|АgCl, KCl или Аg|АgCl, НCl. Электродный процесс: АgCl + е–
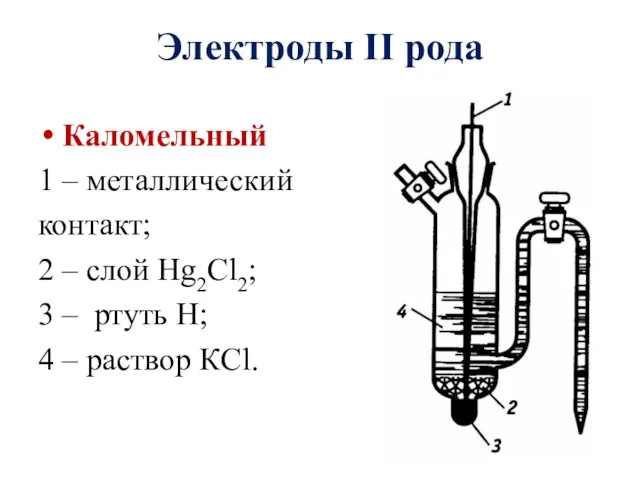
- 13. Каломельный 1 – металлический контакт; 2 – слой Hg2Cl2; 3 – ртуть H; 4 – раствор
- 14. Каломельный электрод Схема: Нg|Нg2Cl2, KCl Электродный процесс: Нg2Cl2 + 2е– ⇄ 2Нg + Cl─ Уравнение Нернста:
- 15. ОВ электроды (RedOx) Схема: Pt | Ох, Red Электродный процесс: Ох + zе– ⇄ Red Уравнение
- 16. ОВ электроды (RedOx) Пример: Pt | Fe3+, Fe2+ Электродный процесс: Fe3+ + е– ⇄ Fe2+ Fe2+
- 17. ОВ электроды (RedOx) Пример: Pt | MnO4─, Mn2+ Электродный процесс: MnO4─ +8Н+ +5ē ⇄ Mn2+ +
- 18. Критерии самопроизвольного протекания ОВ-реакций если ∆G 0. Со3+ + Fe2+ → Fe3+ + Со2+ : ∆Е
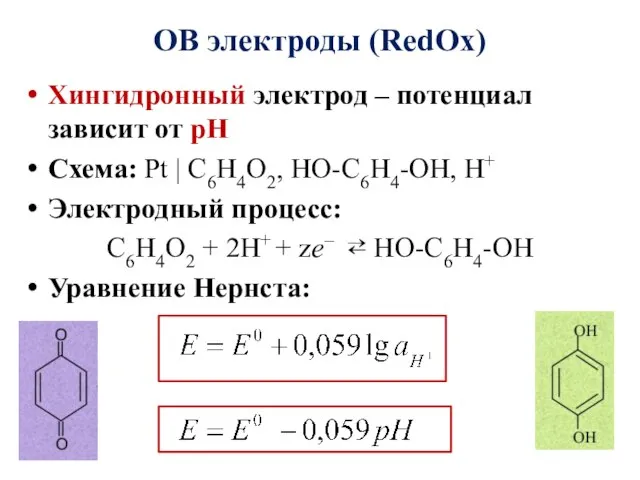
- 19. ОВ электроды (RedOx) Хингидронный электрод – потенциал зависит от рН Схема: Pt | C6H4O2, HO-C6H4-OH, H+
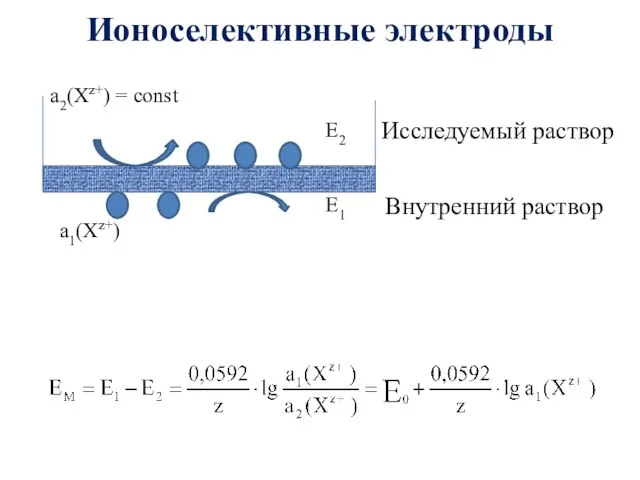
- 20. Ионоселективные электроды Исследуемый раствор Внутренний раствор
- 21. Ионоселективные электроды Стеклянный электрод Схема: Ag ∣ AgCl,KCl ∣ стекло ∣ Н+ ∣ раствор Электродный процесс:
- 23. Скачать презентацию













 Генетические ряды металлов и неметаллов
Генетические ряды металлов и неметаллов Классификация кислот
Классификация кислот Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства ОВР. Реакции
ОВР. Реакции Ртуть
Ртуть Белки
Белки Вымораживание воды
Вымораживание воды Строение и свойства циклоалканов
Строение и свойства циклоалканов Реакции
Реакции Макро- и микромир
Макро- и микромир Дисперсные системы
Дисперсные системы Валентные состояния атома углерода
Валентные состояния атома углерода Химия элементов IVA группы
Химия элементов IVA группы Степень окисления. Составление формул бинарных соединений. 8 класс
Степень окисления. Составление формул бинарных соединений. 8 класс Horľaviny. Horľavá látka
Horľaviny. Horľavá látka Каучук. История открытия каучука
Каучук. История открытия каучука История и методология химии
История и методология химии Валентность. Нахождение химической формулы вещества по валентности
Валентность. Нахождение химической формулы вещества по валентности Химические реакции. Классификация
Химические реакции. Классификация Металлическая и водородная и химическая связь
Металлическая и водородная и химическая связь Кремний и его соединения. Силикатная промышленность
Кремний и его соединения. Силикатная промышленность Металлическая, водородная, Ван-дер-ваальсова химические связи
Металлическая, водородная, Ван-дер-ваальсова химические связи Химическая промышленность
Химическая промышленность Резиновые материалы и клеи. Тема 7.5
Резиновые материалы и клеи. Тема 7.5 Обобщение. Неметаллы
Обобщение. Неметаллы Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ Презентация на тему Органическая химия. Жиры
Презентация на тему Органическая химия. Жиры  Век медный, бронзовый, железный
Век медный, бронзовый, железный