Содержание
- 2. Электролиз растворов и расплавов солей
- 3. Учебная цель: 10.2.3.8 описывать сущность процесса электролиза; 10.2.3.9 применять эмпирические правила для прогнозирования продуктов электролиза на
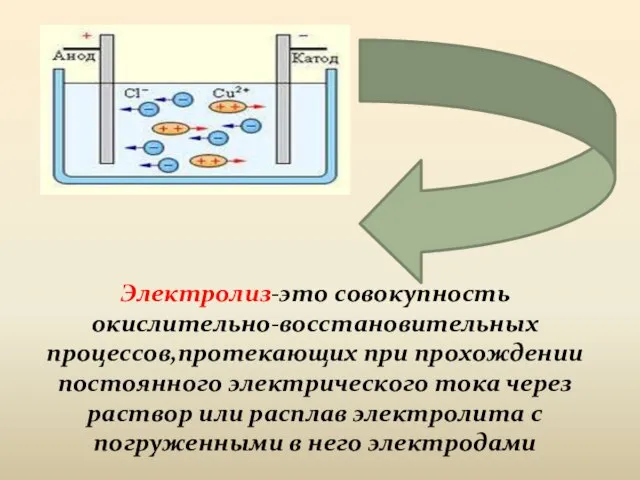
- 4. Электролиз-это совокупность окислительно-восстановительных процессов,протекающих при прохождении постоянного электрического тока через раствор или расплав электролита с погруженными
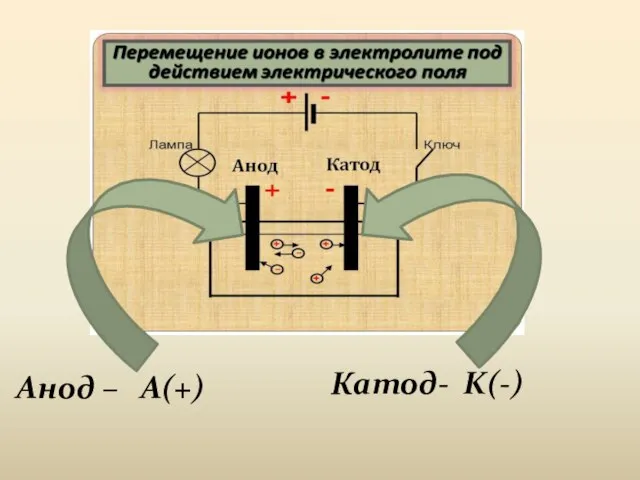
- 5. Катод- K(-) Анод – A(+)
- 6. Электролиз расплава NaBr I. В расплаве электролита присутствуют только ионы, образовавшиеся при его диссоциации, они и
- 7. II. Электролиз водного раствора электролита В отличии от расплава в растворе электролита кроме ионов, получившихся при
- 8. MnZnCrFeCoNiSnPb Если у катода накапливаются катионы металла (стоящего в ряду напряжений после H2), то восстанавливаются ионы
- 9. 3) Если у катода накапливаются катионы металла,который расположен в ряду напряжений (после AL и до H2),то
- 10. 5) При электролизе растворов солей бескислородных кислот( кроме фторидов) окисляются анионы кислотных остатков 2CL- - 2e-=CL2
- 11. 6) При электролизе растворов солей кислородосодержащих кислот и фторидов идет процесс окисления гидроксид-ионов из молекул воды
- 12. Алгоритм составления уравнения электролиза на примере р-ра CuSO4 Записать уравнение диссоциации соли. Записать полуреакцию процесса, который
- 13. 5. Сложить левые и правые части полуреакций, умножив их на коэффициенты, получив сокращенное ионное уравнение. 6.
- 14. Пример составления уравнения электролиза раствора CuSO4
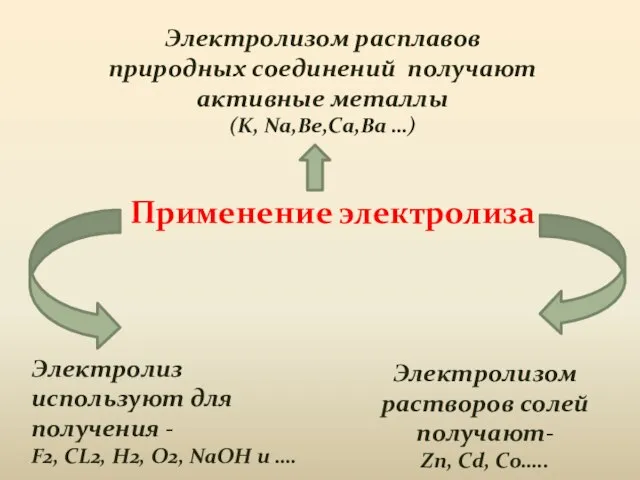
- 15. Применение электролиза Электролизом расплавов природных соединений получают активные металлы (K, Na,Be,Ca,Ba …) Электролизом растворов солей получают-
- 16. Критерий оценивания: составляет уравнение электролиза Дескриптор: Записывает уравнение диссоциации соли (1 балл); Записывает полуреакции, протекающие на
- 17. Записать уравнение электролиза водного раствора нитрата серебра AgNO3. Задание на закрепление:
- 18. Проверь себя 1. При электролизе водного раствора хлорида лития (LiCL) на аноде в результате электролиза образуется:
- 19. Проверь себя 2. При электролизе водного раствора сульфата меди (II) ( CuSO4) на катоде выделится: А)
- 20. Проверь себя 3. Установите соответствие между формулой соли и продуктом,образующимся на инертном аноде при электролизе ее
- 21. Самопроверка 1) В Установите соответствие между формулой соли и продуктом,образующимся на инертном аноде при электролизе ее
- 23. Скачать презентацию

















 Металлы. Строение, свойства, применение
Металлы. Строение, свойства, применение Введение. Основные понятия химии
Введение. Основные понятия химии Химическая организация природы
Химическая организация природы Химические свойства щелочей (тема 6)
Химические свойства щелочей (тема 6) Классификация неорганических соединений
Классификация неорганических соединений Презентация на тему Законы электролиза
Презентация на тему Законы электролиза  Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70
Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70 Сферы применения CaCO3
Сферы применения CaCO3 Лабораторная работа №1. Получение гидроксидов цинка и алюминия и исследование их свойств
Лабораторная работа №1. Получение гидроксидов цинка и алюминия и исследование их свойств Химические методы количественного анализа веществ
Химические методы количественного анализа веществ Липиды. Источники
Липиды. Источники Чистые вещества и смеси
Чистые вещества и смеси Нуклеиновые кислоты
Нуклеиновые кислоты Железо
Железо Алкадиены. Каучук
Алкадиены. Каучук Горение и окисление Учитель: Какурин А.М.
Горение и окисление Учитель: Какурин А.М. Степень окисления
Степень окисления Переработка нефти. 10 класс
Переработка нефти. 10 класс Оксиды углерода
Оксиды углерода Автомобильное дизельное топливо
Автомобильное дизельное топливо Азот
Азот Кислоты основания и соли как электролиты
Кислоты основания и соли как электролиты Водород. Доклад по химии
Водород. Доклад по химии Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас Контрольна робота, хімія
Контрольна робота, хімія Презентация Щелочные металлы
Презентация Щелочные металлы Простые и сложные вещества. Основные классы неорганических веществ
Простые и сложные вещества. Основные классы неорганических веществ Решение расчетных задач по уравнениям реакций
Решение расчетных задач по уравнениям реакций