Содержание
- 2. Lekcijās aplūkoti teorētiskās organiskās ķīmijas pamatjēdzieni, organisko savienojumu galvenās pētīšanas metodes, organisko savienojumu klasifikācija un nomenklatūra.
- 3. VAR UZSKATĪT, KA ORGANISKĀ ĶĪMIJA KĀ ATSEVIŠĶA ĶĪMIJAS NOZARE PASTĀV KOPŠ 1807. GADA, KAD ZVIEDRU ĶĪMIĶIS
- 4. Gandrīz visi organiskie savienojumi satur arī ūdeņradi. Vēlāk redzēsim, ka, aizvietojot ogļūdeņražu molekulās vienu vai vairākus
- 5. Jēdziens par organisko savienojumu uzbūvi (struktūru) radās 1858. – 1861. g., pateicoties Frīdriha Kekulē, Arčibalda Kupera
- 6. Kā redzēsim - sistēmas īpašības nosaka tās struktūra. Tāpat arī organisko vielu īpašības nosaka vielas struktūra.
- 7. Organiskās ķīmijas galvenās sastāvdaļas ir: * organiskā sintēze, * organiskā analīze, * teorētiskā organiskā ķīmija, *
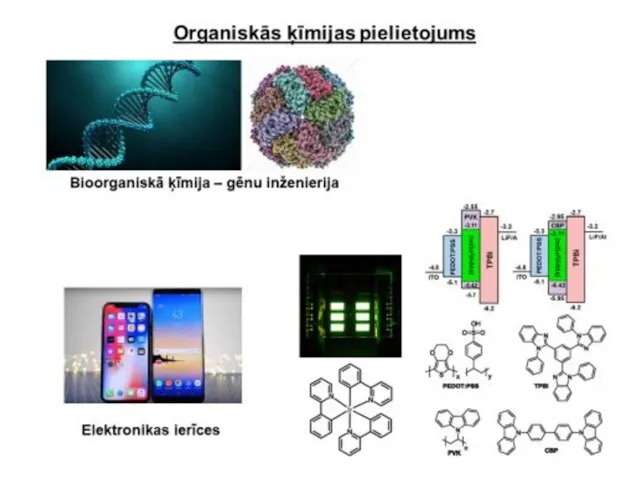
- 8. Uz organiskās ķīmijas un bioķīmijas robežas radušās divas jaunas zinātnes nozares – molekulārā bioloģija un bioorganiskā
- 9. Organiskie savienojumi – nukleīnskābes, olbaltumvielas, ogļhidrāti, tauki, vitamīni, hormoni un daudzi citi ķīmiskie savienojumi - ir
- 10. Rūpnieciskā organiskā sintēze dod ļoti daudzus svarīgus produktus: sintētiskās krāsvielas, monomērus plastmasu, elastomēru (sintētisko kaučuku), tekstilšķiedru
- 13. Vēsturiski pirmais organisko vielu iegūšanas avots bija augu un dzīvnieku valsts. Cilvēki jau sen izmantoja koksnes
- 14. Organisko vielu galvenās attīrīšanas metodes ir kristalizācija, sublimācija, destilācija, hromatogrāfija, gēlu filtrācija, elektroforēze. Absolūti tīru vielu
- 15. Slāpekli, sēru un halogēnus organiskajos savienojumos kvalitatīvi nosaka, vielu sakausējot ar metālisko nātriju, kausējumu sadalot destilētā
- 16. Kvantitatīvu organisko vielu elementanalīzi veic speciālā iekārtā. Oksidē nelielu (ap 1 mg, precīzs iesvars) vielas paraugu,
- 17. Organiskās ķīmijas literatūra Literatūrā aprakstīto organisko savienojumu skaits jau pagājušā gadsimta beigās pārsniedza 20 miljonus. Jaunus
- 18. Lai iegūtu informāciju par kāda noteikta savienojuma sintēzes metodi vai tā īpašībām, jāizmanto speciālā literatūra. Speciālās
- 19. Pirmējie avoti ir raksti žurnālos. Organiskajā sintēzē apmēram 96 % informācijas var iegūt 100 galvenajos žurnālos,
- 20. Otrējie avoti ir referatīvie žurnāli, kas sniedz žurnālos publicēto rakstu īsus atreferējumus. Tie ir Chemical Abstracts,
- 21. Otrējo informāciju sniedz arī apskatu raksti žurnālos, piemēram, Chemical Reviews , Uspekhi Khimii, Accounts of Chemical
- 22. Trešējo informāciju sniedz referatīvo žurnālu un rokasgrāmatu rādītāji (Subject Index, Formula Index, Author Index).
- 23. Sīkāk par informācijas meklēšanu ķīmijā mēs šajā kursā neapskatīsim. Ar vismazāko laika patēriņu vajadzīgo informāciju var
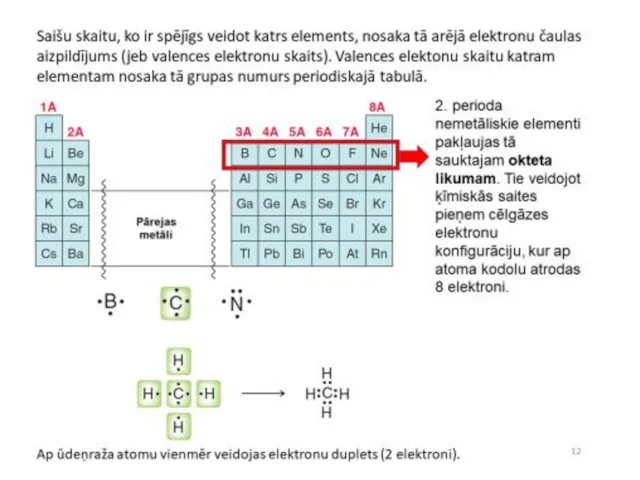
- 24. Teorētiskās organiskās ķīmijas pamatjēdzieni Kā jau minēts 1858. – 1861. g., pateicoties Frīdriha Kekulē, Arčibalda Kupera
- 25. Kovalentā saite var veidoties divējādi: 1) Katra daļiņa, veidojot saiti, dod vienu elektronu. Piemēram, brīvo radikāļu
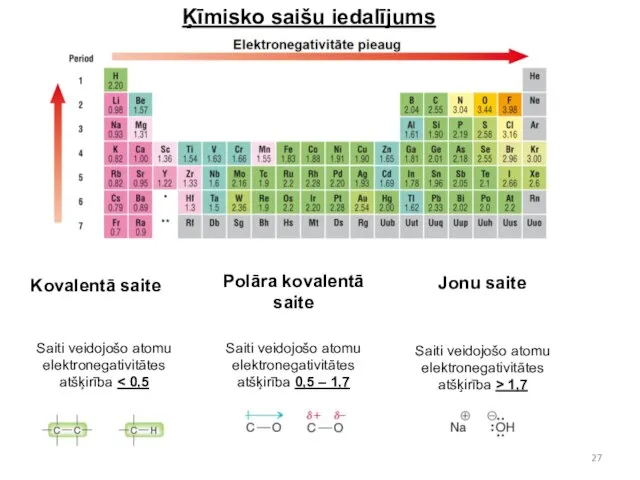
- 27. Ķīmisko saišu iedalījums Kovalentā saite Polāra kovalentā saite Jonu saite Saiti veidojošo atomu elektronegativitātes atšķirība Saiti
- 28. Lainuss Polings izveidoja ķīmisko elementu elektronegativitāšu skalu. Jo elements periodiskajā sistēmā atrodas tuvāk tās labajam augšējam
- 29. Šo hlora atoma elektronisko efektu sauc par negatīvu indukcijas efektu un apzīmē ar -I. Ja atoms,
- 30. Molekulās ar konjugētām divkāršo vai trīskāršo saišu sistēmām un atomiem ar nedalīto elektronu pāri darbojas mezomērais
- 31. Ektronakceptoras grupas RCO, NO2, COOR, C≡N, SO2R (ar R parasti apzīmē ogļūdeņraža atlikumu, t. i. ogļūdeņraža
- 32. Mezomērijas simbols ↔ nozīmē, ka tiek uzrādītas robežstruktūras (mezomērās struktūras), kas reāli neeksistē, bet patiesā molekulas
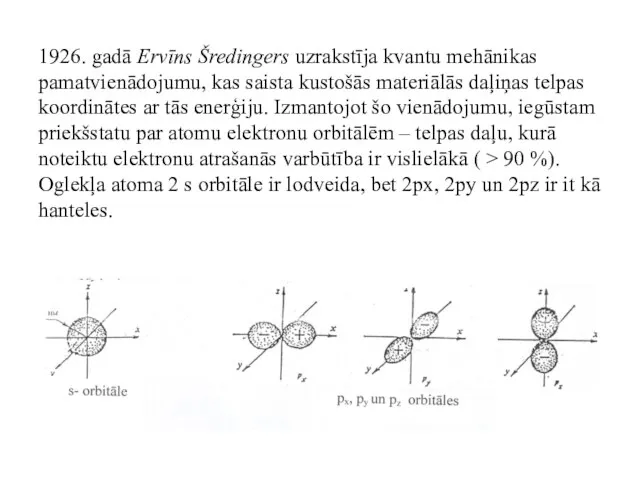
- 33. 1926. gadā Ervīns Šredingers uzrakstīja kvantu mehānikas pamatvienādojumu, kas saista kustošās materiālās daļiņas telpas koordinātes ar
- 34. Ķīmiskās saites veidojas, divu atomu atomārajām orbitālēm pārklājoties – tas ir, izveidojot molekulārās orbitāles – saistītājorbitāli
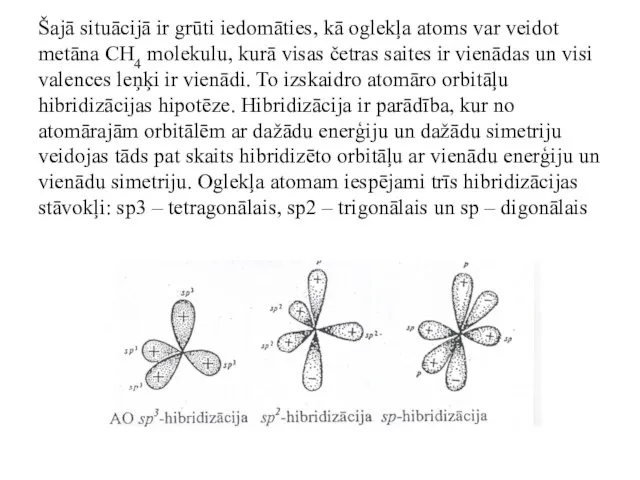
- 35. Šajā situācijā ir grūti iedomāties, kā oglekļa atoms var veidot metāna CH4 molekulu, kurā visas četras
- 36. Tā vispirms pieņem, ka hibridizācijas procesā viens elektrons pāriet no 2s uz 2pz orbitāli. Tad no
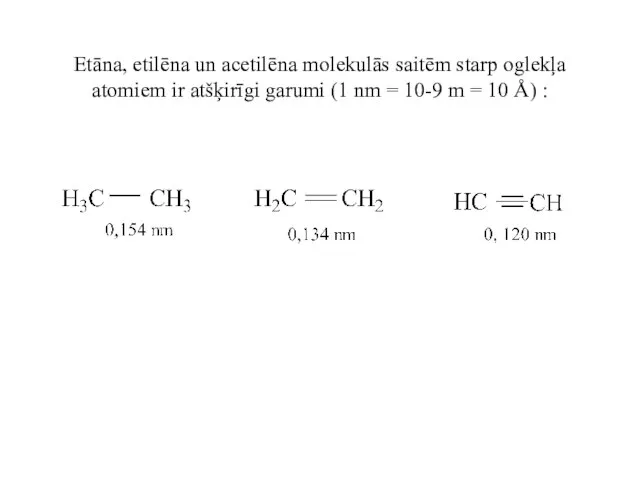
- 37. Etāna, etilēna un acetilēna molekulās saitēm starp oglekļa atomiem ir atšķirīgi garumi (1 nm = 10-9
- 38. Atoma kovalentais rādiuss ir puse no attiecīgās saites garuma, ja saiti veido vienādi atomi. Redzam, ka
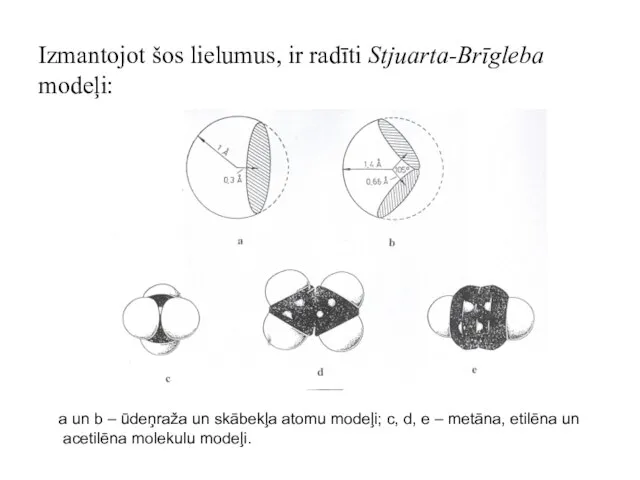
- 39. Izmantojot šos lielumus, ir radīti Stjuarta-Brīgleba modeļi: a un b – ūdeņraža un skābekļa atomu modeļi;
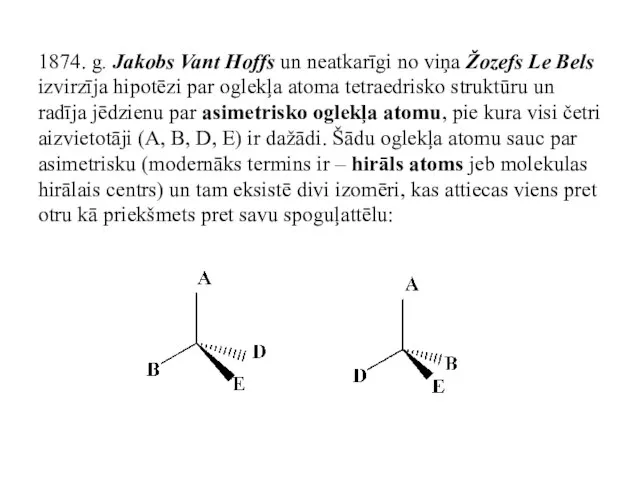
- 40. 1874. g. Jakobs Vant Hoffs un neatkarīgi no viņa Žozefs Le Bels izvirzīja hipotēzi par oglekļa
- 41. Molekulu sauc par hirālu, ja tā nav savietojama ar savu spoguļattēlu. Šos izomērus sauc par optiskajiem
- 42. Parasti organisko savienojumu reakcijās rodas enantiomēru maisījums molārā attiecībā 1 : 1 , to sauc par
- 43. Organisko savienojumu fizikālās pētīšanas metodes Refraktometrija. Izmēra gaismas stara laušanas koeficientu n un aprēķina molāro refrakciju
- 44. Dipolmomenta noteikšana (dielkometrija). Molekulas dipolmomentu μ (mērvienība – debajs, D) nosaka, izmērot gaismas laušanas koeficientu n
- 45. Kalorimetrija. Izmēra vielu molāros sadegšanas siltumus (kJ/mol) arī reakciju siltuma efektus un aprēķina molekulu un saišu
- 46. Elektroķīmiskās metodes. Polarogrāfija pēta elektrona pievienošanos vielai uz piloša dzīvsudraba katoda, voltamperometrija – vielas oksidēšanu uz
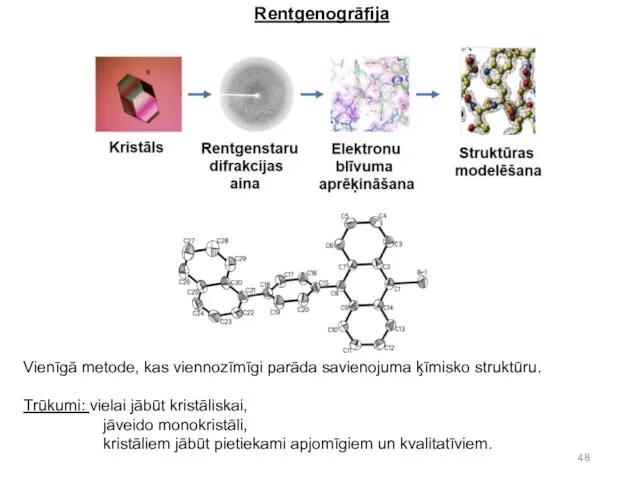
- 47. Rentgenogrāfija (angliski X-Ray Analysis). Pati varenākā struktūranalīzes metode, kas pēta rentgenstaru difrakciju vielas kristālā. Metode sniedz
- 48. Rentgenogrāfija Vienīgā metode, kas viennozīmīgi parāda savienojuma ķīmisko struktūru. Trūkumi: vielai jābūt kristāliskai, jāveido monokristāli, kristāliem
- 49. Elektronogrāfija un neitronogrāfija arī ir struktūranalīzes metodes, kas attiecīgi balstās uz elektronu vai neitronu difrakciju, šīm
- 50. Elektronu absorbcijas spektroskopija. Mēra ultravioletās un redzamās gaismas absorbcijas intensitāti kā funkciju no gaismas viļņu garuma
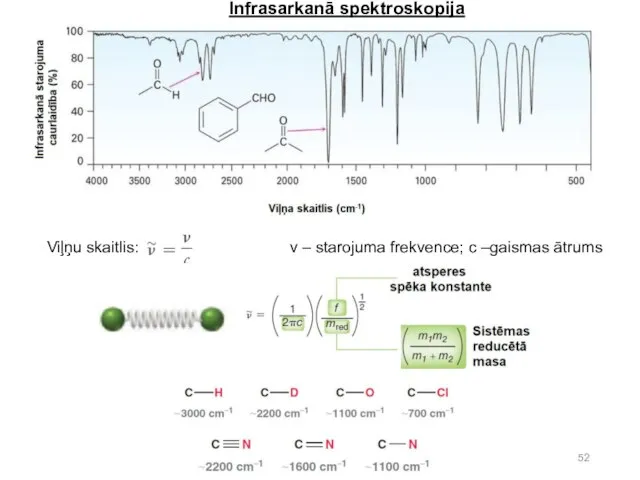
- 51. Infrasarkanā absorbcijas spektroskopija. Mēra infrasarkanās gaismas absorbcijas intensitāti kā funkciju no gaismas viļņu garuma vielu suspensijās
- 52. Infrasarkanā spektroskopija Viļņu skaitlis: ν – starojuma frekvence; c –gaismas ātrums
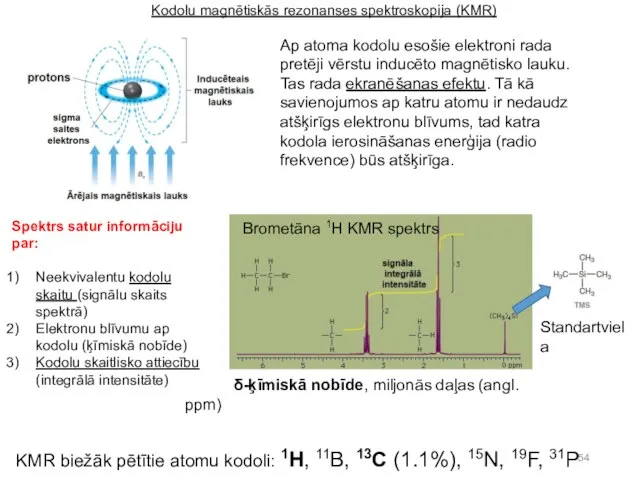
- 53. Kodolu magnētiskās rezonanses spektroskopija (KMR). KMR ir radiospektroskopijas metode. Ievietojot vielas paraugu spēcīgā magnētiskā laukā, tās
- 54. Kodolu magnētiskās rezonanses spektroskopija (KMR) Ap atoma kodolu esošie elektroni rada pretēji vērstu inducēto magnētisko lauku.
- 55. Elektronu paramagnētiskā rezonanse (EPR, angliski Electron Spin Resonance, ESR). EPR spektroskopijas metode ir līdzīga KMR metodei,
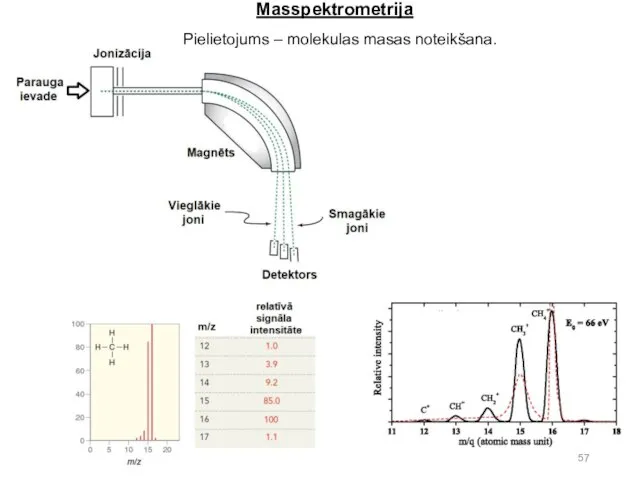
- 56. Masspektrometrija. Organisko savienojumu dziļā vakuumā bombardē ar vidējas enerģijas (visbiežāk 70 eV) elektroniem, no molekulas tiek
- 57. Masspektrometrija Pielietojums – molekulas masas noteikšana.
- 58. Organisko savienojumu reaģētspējas pamatjēdzieni Ķīmiskās reakcijas ir procesi, kuros notiek elektronu blīvuma izmaiņas reaģējošā sistēmā, vienu
- 59. Ķīmiskā kinētika pēta reakciju ātrumu. Pirmās kārtas reakcijas (A→X) ātrums (v) ir proporcionāls reaģējošās vielas koncentrācijas
- 60. Reakcijas ātruma konstantes atkarību no temperatūras raksturo Arēniusa vienādojums: k = A e-Ea/RT, kur k –
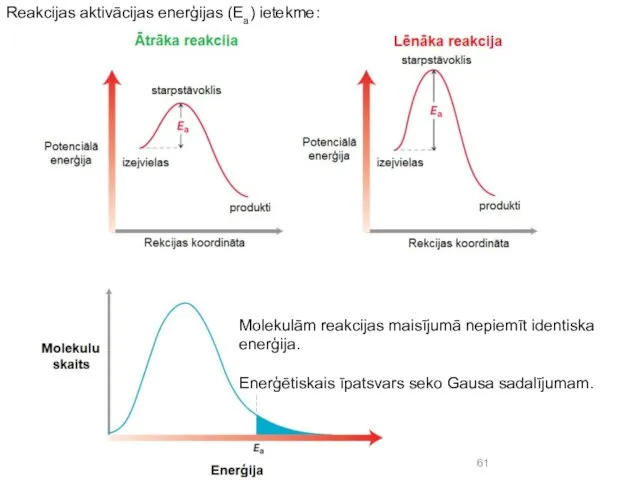
- 61. Reakcijas aktivācijas enerģijas (Ea) ietekme: Molekulām reakcijas maisījumā nepiemīt identiska enerģija. Enerģētiskais īpatsvars seko Gausa sadalījumam.
- 62. Lai divas daļiņas (molekulas, atomi, joni) varētu savstarpēji reaģēt, tām ir jāsaduras. Taču reakcija notiek tikai
- 63. Reakciju tipi un reaģenti. Organisko savienojumu reakcijas klasificē: pēc saišu saraušanas un veidošanā veida. pēc ķīmisko
- 64. Pēc saišu saraušanas un veidošanās veida reakcijas iedala: 1) Homolītiskās reakcijas 2) Heterolītiskās reakcijas
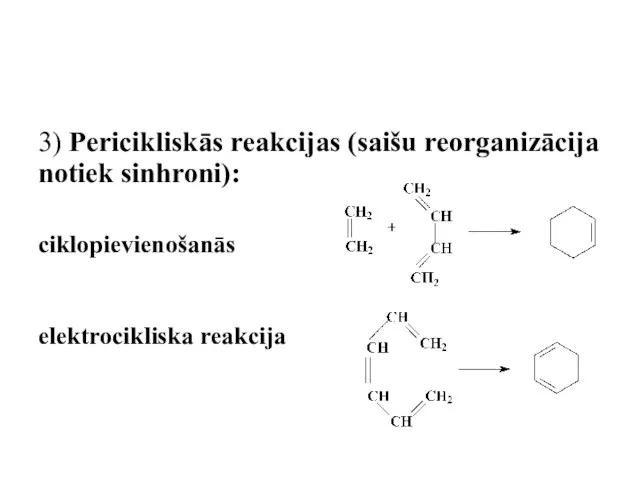
- 65. 3) Pericikliskās reakcijas (saišu reorganizācija notiek sinhroni): ciklopievienošanās elektrocikliska reakcija
- 66. Pēc ķīmisko pārvērtību rakstura reakcijas iedala: viena elektrona pārnese disociācija un rekombinācija aizvietošanās atšķelšanās
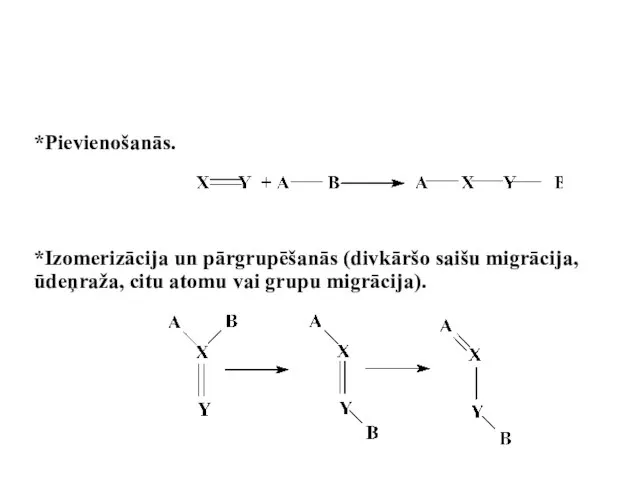
- 67. *Pievienošanās. *Izomerizācija un pārgrupēšanās (divkāršo saišu migrācija, ūdeņraža, citu atomu vai grupu migrācija).
- 68. Viena elektrona pārnese, kā arī disociācija un rekombinācija ir elementārakti. Aizvietošanās, atšķelšanās, pievienošanās, izomerizācijas un pārgrupēšanās
- 69. Reaģenti heterolītiskajās reakcijās. Izšķir nukleofilos un elektrofilos reaģentus. Par nukleofiliem reaģentiem sauc daļiņas ar elektrondonorām īpašībām,
- 70. Nukleofilos reaģentus iedala pēc nukleofilā atoma tipa: H-nukleofili: H:- (hidrīdjons), BH4-, AlH4-; C-nukleofili: R:- (karbanjoni), Rδ-—Mδ+
- 71. Par elektrofiliem reaģentiem sauc daļiņas ar elektronakceptorām īpašībām, kuras veido saiti ar nukleofilu partneri, saistot abus
- 72. Elektrofilos reaģentus iedala pēc elektrofilā atoma tipa: H-elektrofili: H+X- (stipras skābes); B-elektrofili: BF3 ; C-elektrofili: R3C+,
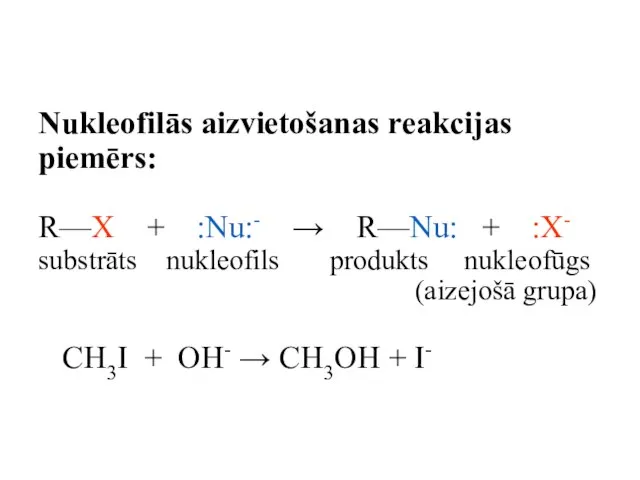
- 73. Nukleofilās aizvietošanas reakcijas piemērs: R—X + :Nu:- → R—Nu: + :X- substrāts nukleofils produkts nukleofūgs (aizejošā
- 74. Elektrofilās aizvietošanas reakcijas piemērs: R—Y + E+ → R—E + Y+ substrāts elektrofils produkts elektrofūgs (aizejošā
- 75. Molekulās ar polarizētu saiti vienmēr eksistē abi reaģējošie centri – nukleofilais un elektrofilais: Alkillitija vai ketona
- 76. Organisko savienojumu klasifikācija un nomenklatūra Organiskos savienojumus klasificē pēc diviem pamatprincipiem: -- pēc oglekļa atomu sakārtojuma
- 77. Atkarībā no oglekļa atomu sakārtojuma molekulā organiskos savienojumus iedala trīs lielās grupās: 1) vaļējas virknes jeb
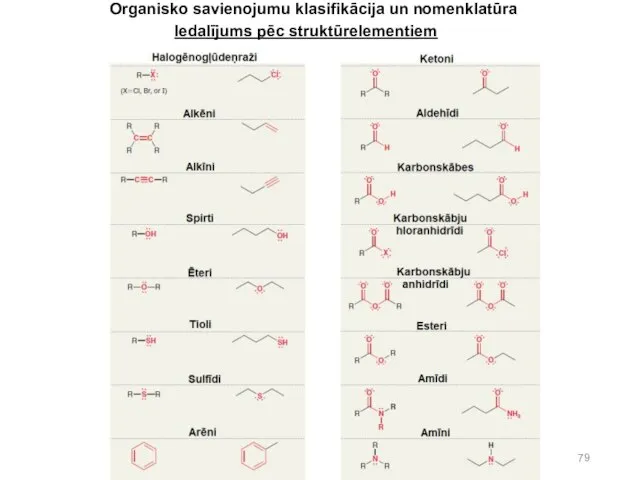
- 78. Pēc struktūrelementiem organiskos savienojumus iedala: * halogēn-atvasinājumos (RCl, RBr, ArI, HetI,ar Ar parasti apzīmē aromātiskā ogļūdeņraža
- 79. Organisko savienojumu klasifikācija un nomenklatūra Iedalījums pēc struktūrelementiem
- 80. Organiskās ķīmijas attīstības sākumposmā, kad vēl nebija izstrādāta klasifikācija, organiskajiem savienojumiem piešķīra nosaukumus atkarībā no izolēšanas
- 81. Vēlāk izveidojās tā sauktā racionālā nomenklatūra, kas nosauca savienojumus pēc attiecīgā tipa: metilspirts, etilspirts, propilspirts, metilamīns
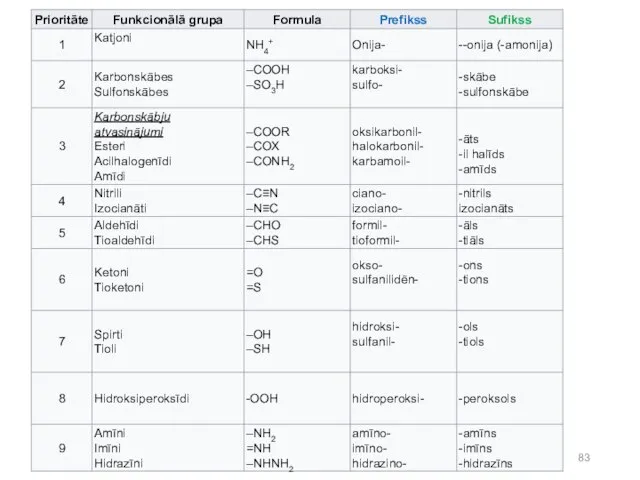
- 82. Daži IUPAC nomenklatūras pamatprincipi: nosaukuma pamatu veido pēc acikliskas molekulas garākās virknes, cikliskas vai heterocikliskas sistēmas
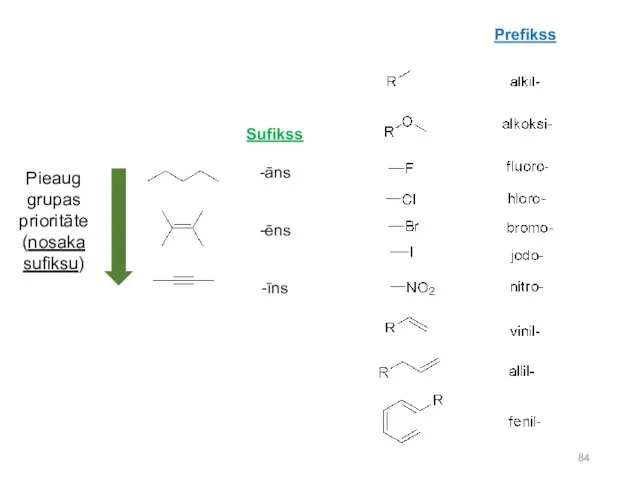
- 84. Sufikss -āns -ēns -īns Prefikss Pieaug grupas prioritāte (nosaka sufiksu)
- 85. nosaukumā ar piedēkļiem apzīmē divkāršās (ēn) un trīskāršās (īn) saites un vecāko aizvietotāju. Pārejos aizvietotājus nosauc
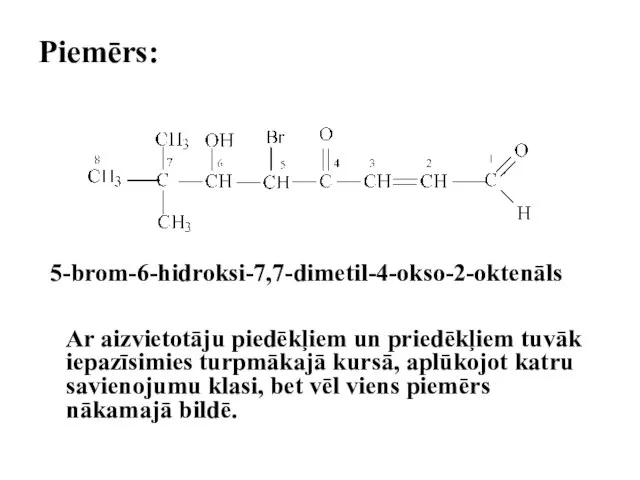
- 86. Piemērs: 5-brom-6-hidroksi-7,7-dimetil-4-okso-2-oktenāls Ar aizvietotāju piedēkļiem un priedēkļiem tuvāk iepazīsimies turpmākajā kursā, aplūkojot katru savienojumu klasi, bet
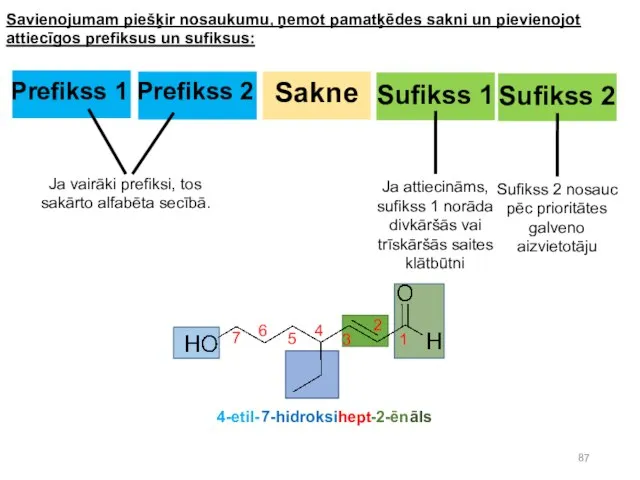
- 87. Savienojumam piešķir nosaukumu, ņemot pamatķēdes sakni un pievienojot attiecīgos prefiksus un sufiksus: Sakne Prefikss 2 Prefikss
- 89. Скачать презентацию

































































 Распределение полициклических ароматических углеводородов в углях Кузнецкого угольного бассейна
Распределение полициклических ароматических углеводородов в углях Кузнецкого угольного бассейна Полезные кирпичи окружающего мира
Полезные кирпичи окружающего мира Положительно (+) заряженные частицы. Катионы
Положительно (+) заряженные частицы. Катионы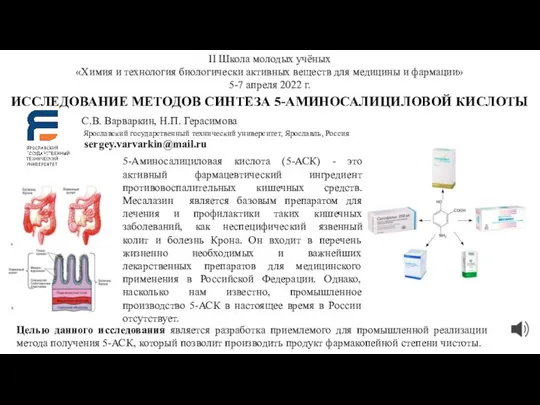 Исследование методов синтеза 5-аминосалициловой кислоты
Исследование методов синтеза 5-аминосалициловой кислоты Задания для подготовки к ЕГЭ по химии
Задания для подготовки к ЕГЭ по химии Сильные и слабые кислоты и основания
Сильные и слабые кислоты и основания Презентация на тему Актуальные проблемы газовой отрасли России
Презентация на тему Актуальные проблемы газовой отрасли России  Презентация на тему Интересные факты из жизни Д. И. Менделеева
Презентация на тему Интересные факты из жизни Д. И. Менделеева  Презентация на тему Почему протекают химические реакции
Презентация на тему Почему протекают химические реакции  Средства ухода за кожей
Средства ухода за кожей 4_Жиры 2020
4_Жиры 2020 Алкены. Тестирование
Алкены. Тестирование Водные биоресурсы и аквакультура. Расчеты в объемном анализе
Водные биоресурсы и аквакультура. Расчеты в объемном анализе ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов
ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов Загадки химии. Занятие 4
Загадки химии. Занятие 4 Портландцемент гидравликалық байланыстырғыш
Портландцемент гидравликалық байланыстырғыш Презентация на тему Виды химической связи и типы кристаллических решеток
Презентация на тему Виды химической связи и типы кристаллических решеток  Супер-химия. Викторина
Супер-химия. Викторина Шуточные загадки Периодической системы химических элементов
Шуточные загадки Периодической системы химических элементов Кислоты. Состав кислот, их классификация и физические свойства, 8 класс
Кислоты. Состав кислот, их классификация и физические свойства, 8 класс Путешествие в мир кислот
Путешествие в мир кислот Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева
Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева  Презентация на тему Полисахариды
Презентация на тему Полисахариды  Строение, свойства и функции аминокислот и белков
Строение, свойства и функции аминокислот и белков Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа
Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа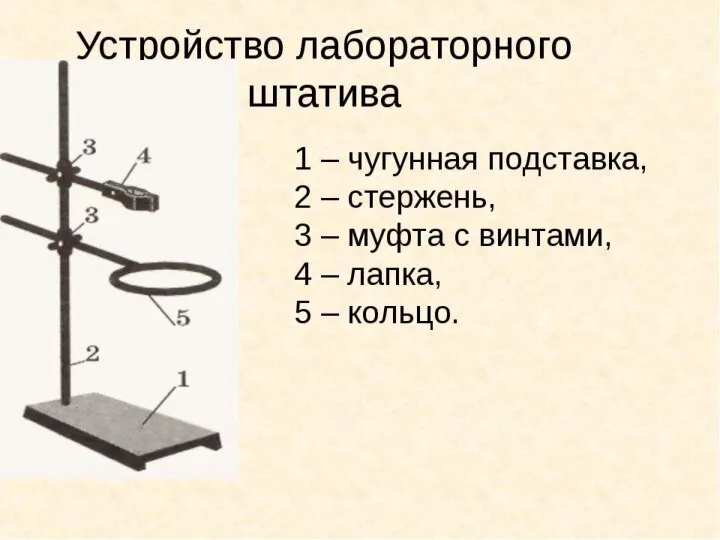 Устройство лабораторного штатива
Устройство лабораторного штатива Подготовка газа к транспорту с применением процесса низкотемпературной сепарации
Подготовка газа к транспорту с применением процесса низкотемпературной сепарации Дисперсные системы с твёрдой средой и газообразной фазой
Дисперсные системы с твёрдой средой и газообразной фазой