Содержание
- 2. Количество электронов в оболочке атома соответствует числу протонов в ядре атома.
- 3. Орбиталь — пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона
- 4. Орбитали составляют энергетические уровни.
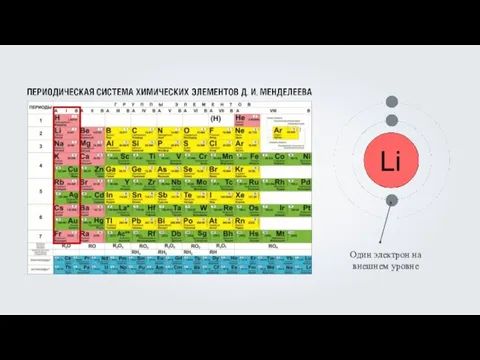
- 6. Электронная оболочка атомов первого периода содержит один энергетический уровень.
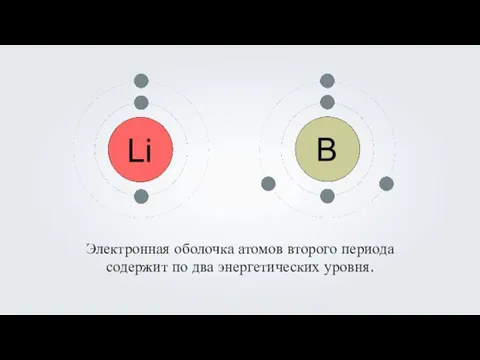
- 7. Электронная оболочка атомов второго периода содержит по два энергетических уровня.
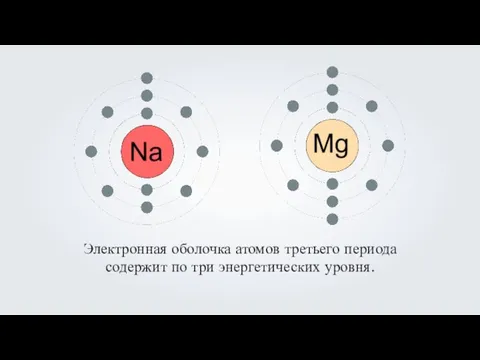
- 8. Электронная оболочка атомов третьего периода содержит по три энергетических уровня.
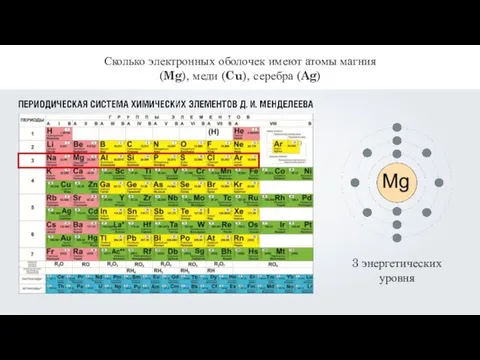
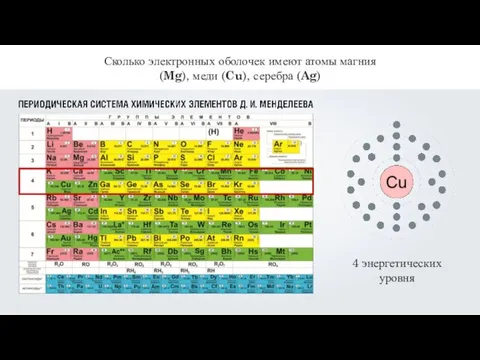
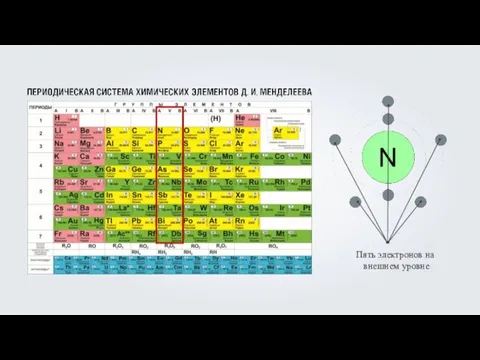
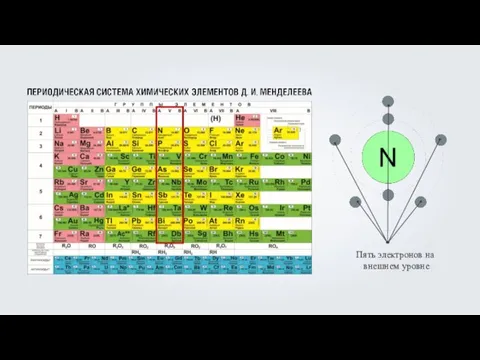
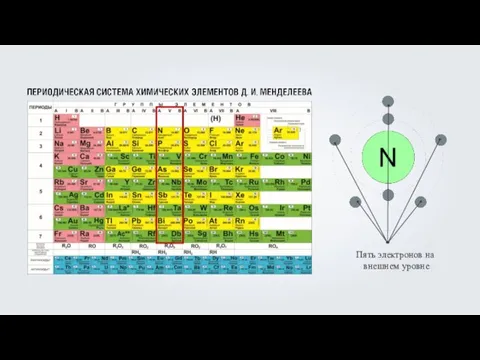
- 9. Сколько электронных оболочек имеют атомы магния (Mg), меди (Cu), серебра (Ag)
- 10. Сколько электронных оболочек имеют атомы магния (Mg), меди (Cu), серебра (Ag)
- 11. Сколько электронных оболочек имеют атомы магния (Mg), меди (Cu), серебра (Ag) 5 энергетических уровней
- 12. Максимальное число электронов, находящихся на энергетическом уровне можно определить по следующей формуле: 2n2
- 13. Максимальное количество электронов на первом уровне: 2⋅12= 2 Максимальное количество электронов на втором уровне: 2⋅22= 8
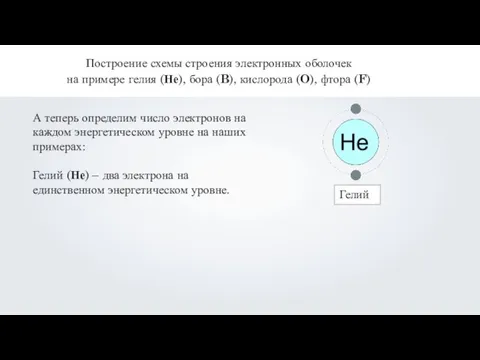
- 20. Построение схемы строения электронных оболочек на примере гелия (Не), бора (B), кислорода (O), фтора (F) 1.
- 21. Построение схемы строения электронных оболочек на примере гелия (Не), бора (B), кислорода (O), фтора (F) Определим
- 22. Построение схемы строения электронных оболочек на примере гелия (Не), бора (B), кислорода (O), фтора (F) А
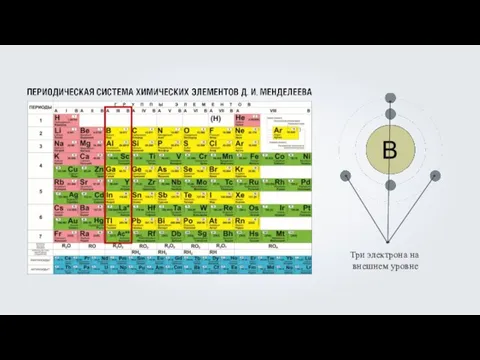
- 23. Построение схемы строения электронных оболочек на примере гелия (Не), бора (B), кислорода (O), фтора (F) Бор
- 24. Построение схемы строения электронных оболочек на примере гелия (Не), бора (B), кислорода (O), фтора (F) Кислород
- 25. Построение схемы строения электронных оболочек на примере гелия (Не), бора (B), кислорода (O), фтора (F) Фтор
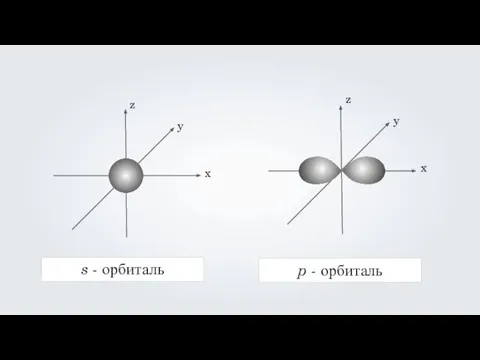
- 26. s - орбиталь p - орбиталь z y x z y x
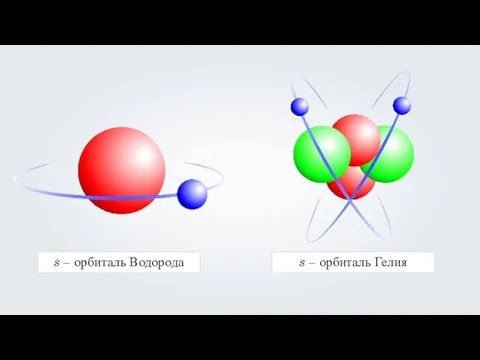
- 27. s – орбиталь Водорода s – орбиталь Гелия
- 28. Н – 1S1 He – 1S2 Li – 1S22S1 Mg – 1S22S22p63S2 B – 1S22S22p1 Электронные
- 30. Скачать презентацию













 Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Соли. Свойства. Получение
Соли. Свойства. Получение Неорганическая химия, часть 1
Неорганическая химия, часть 1 Вуглеводні. Метан як представник насичених вуглеводнів
Вуглеводні. Метан як представник насичених вуглеводнів Изомерия. Виды изомерии
Изомерия. Виды изомерии Фосфор
Фосфор Готовимся к ЕГЭ по органической химии Ароматические углеводороды
Готовимся к ЕГЭ по органической химии Ароматические углеводороды Кислоты
Кислоты Природный газ. 10 класс
Природный газ. 10 класс Chemické reakcie
Chemické reakcie Фепромарон. Химическое название
Фепромарон. Химическое название Классификация и номенклатура аминов. 11 класс
Классификация и номенклатура аминов. 11 класс Пайданалылған майларды қолдана отырып көмірді брикеттер алу
Пайданалылған майларды қолдана отырып көмірді брикеттер алу Презентация на тему Классификация химических реакций 11 класс
Презентация на тему Классификация химических реакций 11 класс  Презентация на тему Уголь
Презентация на тему Уголь  Растворы. 11 класс
Растворы. 11 класс Основания, состав и классификация
Основания, состав и классификация Металлы. Общие свойства
Металлы. Общие свойства Консистентные смазки для легковых автомобилей
Консистентные смазки для легковых автомобилей Химические реакции. Классификация
Химические реакции. Классификация Получение и химические свойства металлов
Получение и химические свойства металлов Практикум по химии и технологии нефти и газа
Практикум по химии и технологии нефти и газа Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы Биологическое окисление
Биологическое окисление Алкины
Алкины 10_Valentnost_khimicheskikh_elementov
10_Valentnost_khimicheskikh_elementov Кислоты 9 класс
Кислоты 9 класс Электрохимические процессы
Электрохимические процессы