Содержание
- 2. Цели урока: Сформировать у учащихся знаний о фосфоре как о химическом элементе и простом веществе; аллотропных
- 3. Открытие фосфора Гамбургский алхимик Хеннинг Бранд 1669 год «Фосфор» - от греческого «светоносный»
- 4. период Фосфор как химический элемент группа валентных электронов степени окисления высший оксид водородное соединение
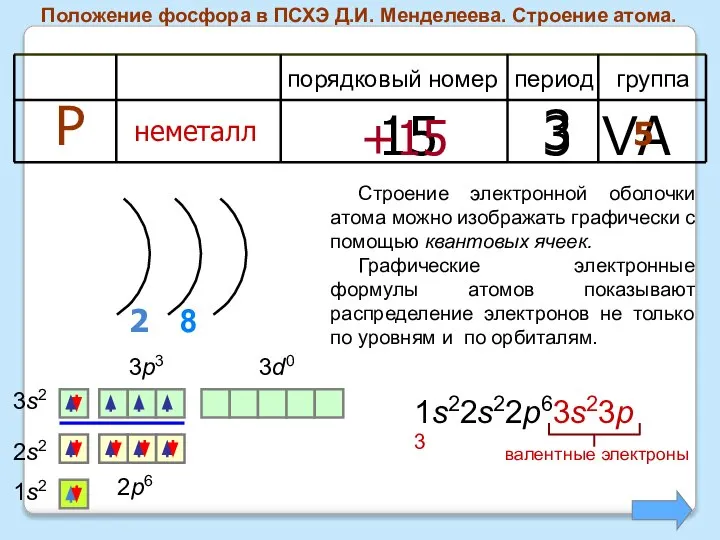
- 5. Положение фосфора в ПСХЭ Д.И. Менделеева. Строение атома. период группа порядковый номер Р неметалл 15 3
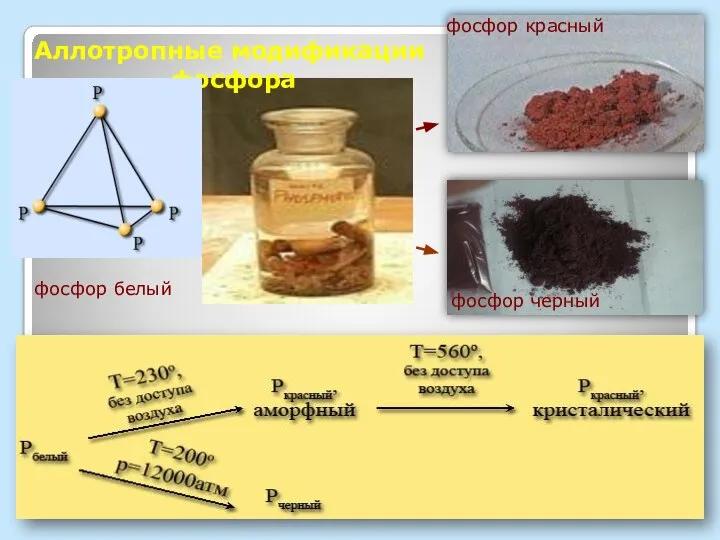
- 6. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ Р БЕЛЫЙ КРАСНЫЙ ЧЕРНЫЙ Сравните физические свойства АЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
- 7. Аллотропные модификации фосфора фосфор белый фосфор черный фосфор красный
- 8. Белый фосфор - твердое кристаллическое вещество, плотность его 1,82 г/см3. На воздухе самовоспламеняется, в темноте светится.
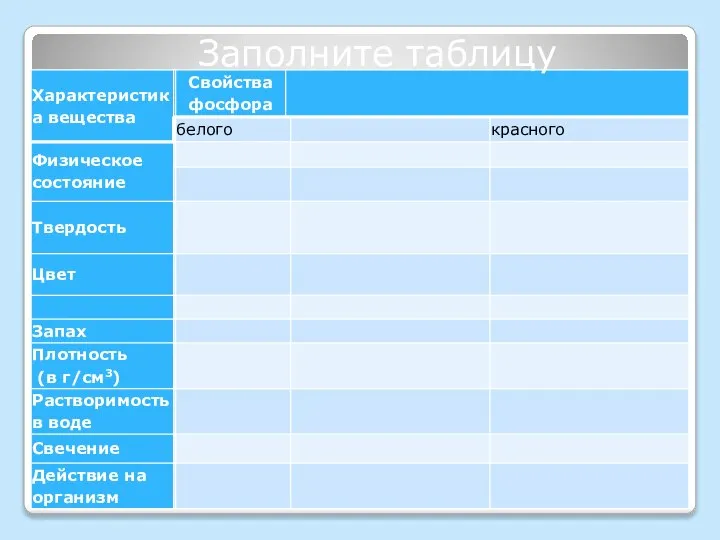
- 9. Заполните таблицу
- 10. ХИМИЧЕСКИЕ СВОЙСТВА С металлами: Ca + P = C неметаллами: P + O2 = P +
- 11. с бертолетовой солью при ударе взрывается, воспламеняется: KClO3 + P = P2O5 + KCl (уравнять!)
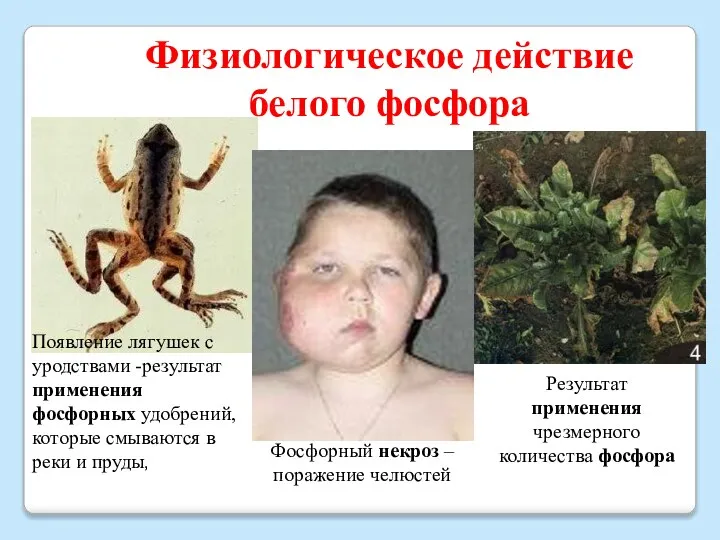
- 12. Физиологическое действие белого фосфора Результат применения чрезмерного количества фосфора Появление лягушек с уродствами -результат применения фосфорных
- 13. Применение фосфора 1 2 7 8 9 3 6 4 5 Белый фосфор применяется для получения
- 14. Получение фосфора нагреванием смеси фосфорита, угля и песка в электропечи: Ca3(PO4)2 + C + SiO2 →
- 16. Скачать презентацию









 Electrochemical properties of arylsilanes
Electrochemical properties of arylsilanes Методы защиты металлов от электрохимической коррозии. Классификация методов защиты
Методы защиты металлов от электрохимической коррозии. Классификация методов защиты Фосфор. Урок в 9 классе
Фосфор. Урок в 9 классе Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Алканы – строение, химические свойства
Алканы – строение, химические свойства Неметаллы в ПСХЭ
Неметаллы в ПСХЭ Загадки химии
Загадки химии Галогеналканы и реакции отщепления
Галогеналканы и реакции отщепления Алкины. Строение, номенклатура, изометрия, физические свойства
Алкины. Строение, номенклатура, изометрия, физические свойства Азот
Азот Классификация органических соединений
Классификация органических соединений Determination of optical properties of pentacoordinated silicon complexes using DFT method
Determination of optical properties of pentacoordinated silicon complexes using DFT method Степень окисления
Степень окисления Ковалентная связь
Ковалентная связь Нихром. Физические свойства
Нихром. Физические свойства Химические формулы
Химические формулы Экстракция молибдена из азотнокислых растворов карбамоилметилфосфиноксидом, растворенным в высших спиртах
Экстракция молибдена из азотнокислых растворов карбамоилметилфосфиноксидом, растворенным в высших спиртах Углеводы
Углеводы Техника безопасности при использовании различных видов топлива. Практическая работа № 3
Техника безопасности при использовании различных видов топлива. Практическая работа № 3 Каучук
Каучук Электронное строение
Электронное строение Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Процесс диссоциации
Процесс диссоциации Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Амины
Амины Карбон
Карбон Атомы, вещества, молекулы
Атомы, вещества, молекулы Химические уравнения
Химические уравнения