Содержание
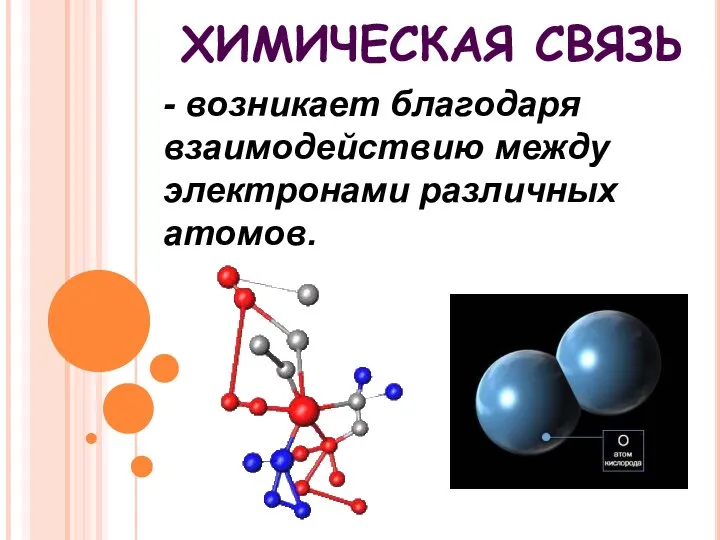
- 2. - возникает благодаря взаимодействию между электронами различных атомов. ХИМИЧЕСКАЯ СВЯЗЬ
- 3. Электроотрицательность. Виды химической связи. Э.О. – свойство атомов данного элемента оттягивать на себя электроны от атомов
- 4. ИЗМЕНЕНИЕ ЭО АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ ПО ПЕРИОДУ ПО ГРУППЕ По периоду слева направо ЭО возрастает. Т.к.
- 5. ВИДЫ ХИМИЧЕСКИХ СВЯЗЕЙ Ионная (И.С.) Металлическая (Ме.С.) Образуется между Ме и неМе Образована атомами Ме Ковалентная
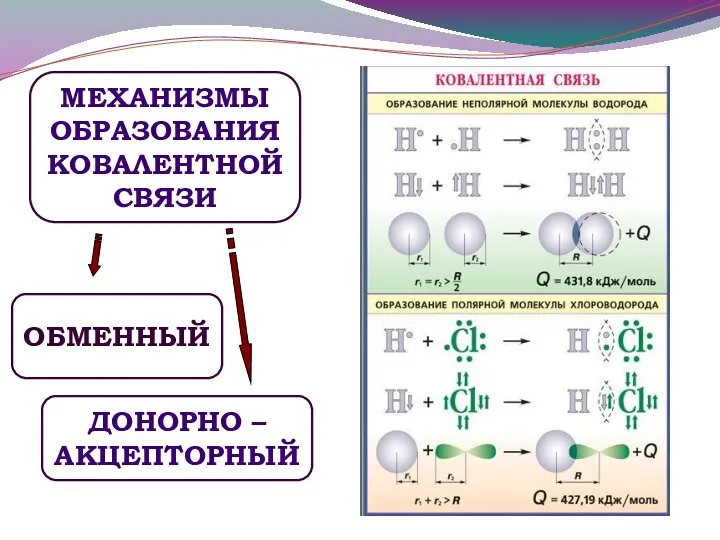
- 6. МЕХАНИЗМЫ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ ОБМЕННЫЙ ДОНОРНО – АКЦЕПТОРНЫЙ
- 7. Образование КНС
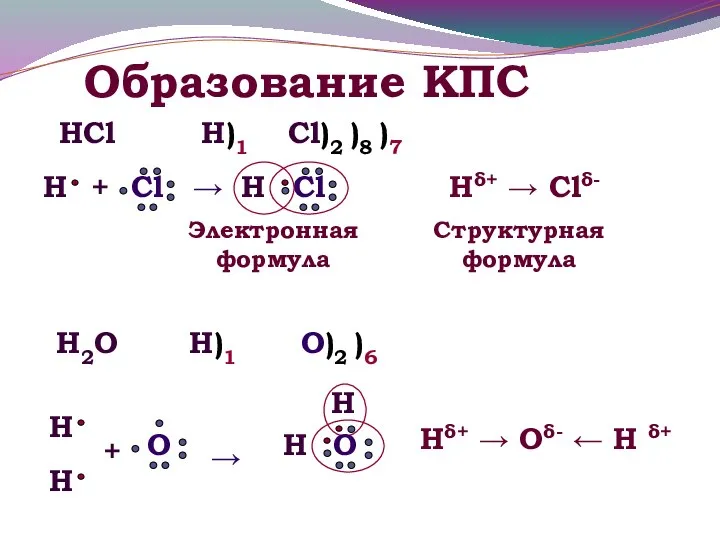
- 8. Образование КПС HCl Н)1 Hδ+ → Clδ- Электронная формула Структурная формула Cl)2 )8 )7 H2O Н)1
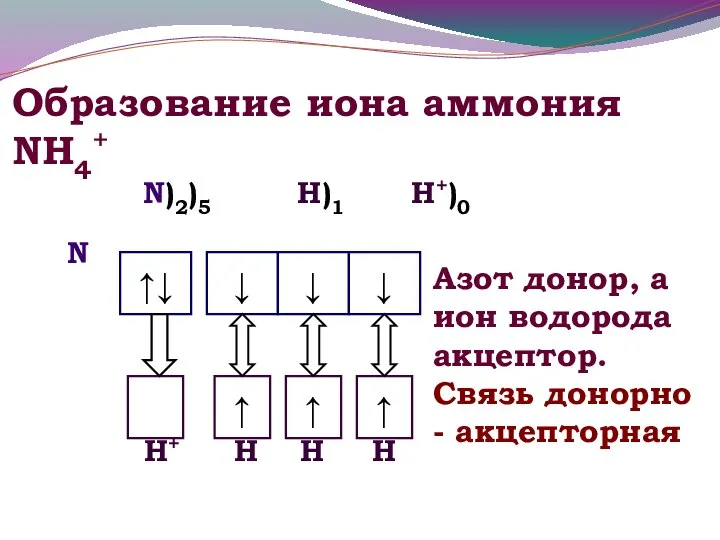
- 9. Образование иона аммония NH4+ Н+ N Н Н Н N)2)5 Н)1 Н+)0 Азот донор, а ион
- 10. Образование ИС NaCl Na )2 )8 )1 Электронная формула Cl)2 )8 )7 Na2O O)2 )6 Na
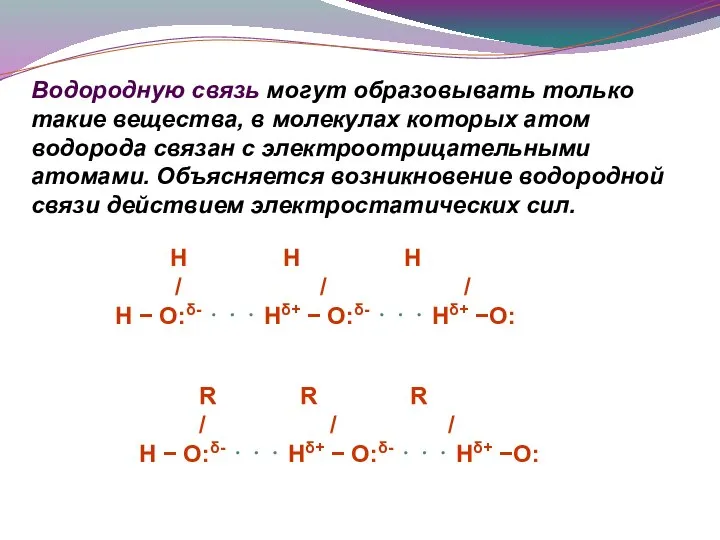
- 11. Водородную связь могут образовывать только такие вещества, в молекулах которых атом водорода связан с электроотрицательными атомами.
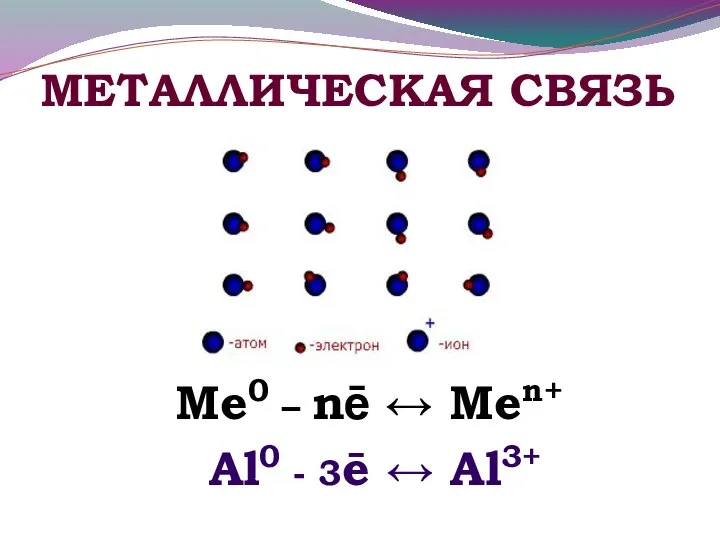
- 12. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ Ме0 – nē ↔ Меn+ Al0 - 3ē ↔ Al3+
- 13. ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ.
- 14. Важной характеристикой химической связи является ее энергия. Это мера прочности связи. Ее величина определяется выделенной или
- 15. Также важна длина связи - расстояние между центрами ядер атома в молекуле или кристалле. Например: Длина
- 16. Число ковалентных связей, которое способен образовывать некоторый атом в каждом конкретном случае ограничено числом тех валентных
- 17. НАПРАВЛЕННОСТЬ ХИМИЧЕСКИХ СВЯЗЕЙ
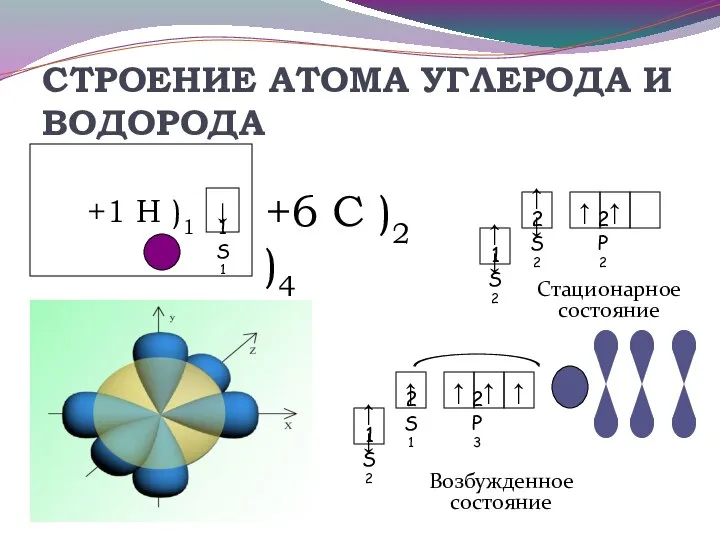
- 18. СТРОЕНИЕ АТОМА УГЛЕРОДА И ВОДОРОДА Возбужденное состояние +6 С )2 )4 Стационарное состояние
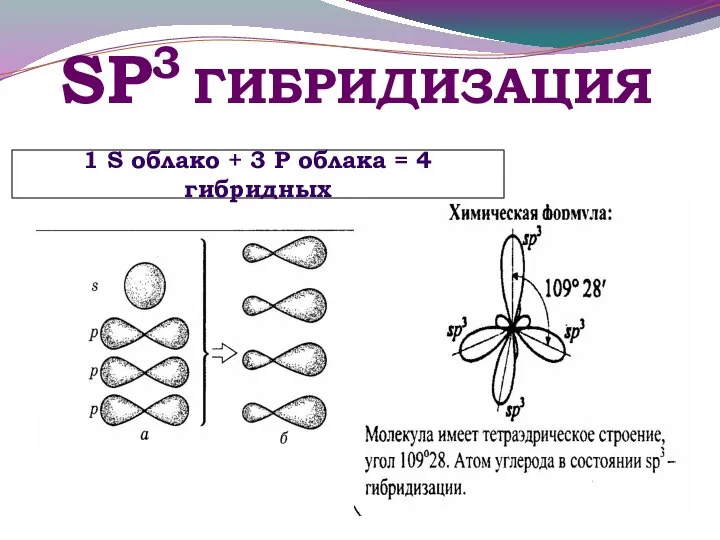
- 19. SР3 ГИБРИДИЗАЦИЯ 1 S облако + 3 Р облака = 4 гибридных
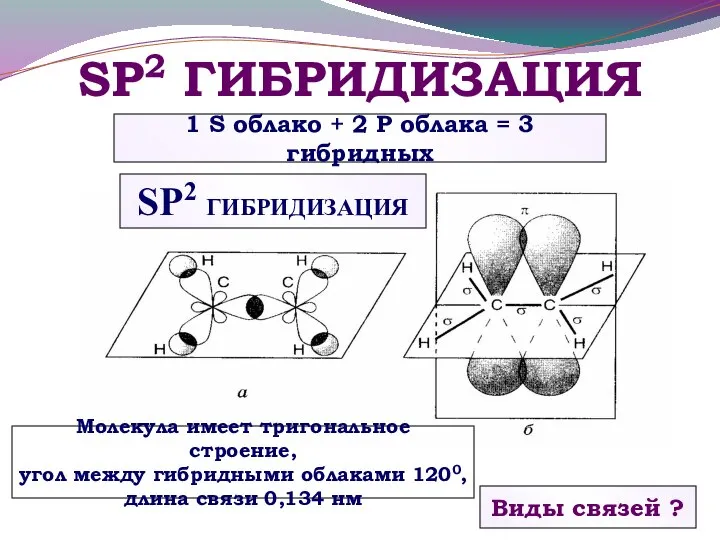
- 20. SP2 ГИБРИДИЗАЦИЯ Виды связей ? Молекула имеет тригональное строение, угол между гибридными облаками 1200, длина связи
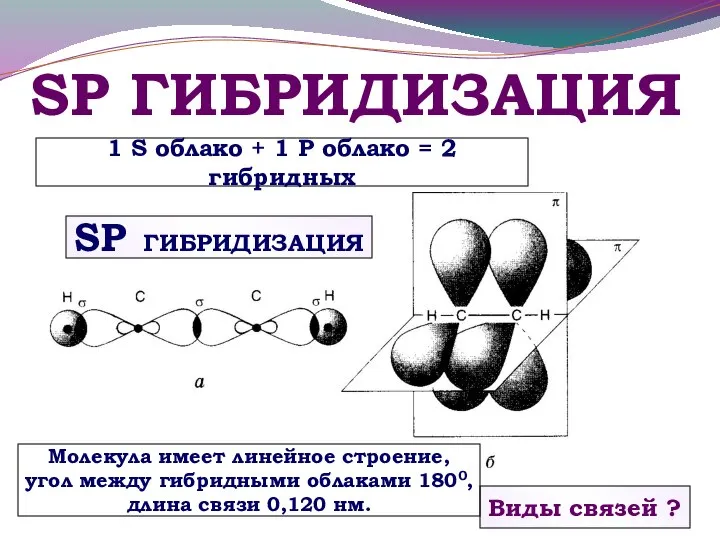
- 21. SP ГИБРИДИЗАЦИЯ Виды связей ? Молекула имеет линейное строение, угол между гибридными облаками 1800, длина связи
- 23. Скачать презентацию









 Амины. Аминокислоты
Амины. Аминокислоты Спирты или алканолы
Спирты или алканолы Ліпіди
Ліпіди Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"  Валентность
Валентность Структура и свойства чистого титана
Структура и свойства чистого титана Получение и применение алканов (10 класс)
Получение и применение алканов (10 класс) Презентация на тему Соединения серы
Презентация на тему Соединения серы  Кальций в океане: кораллы и жемчуг. Кальций в строительстве: гипс и алебастр
Кальций в океане: кораллы и жемчуг. Кальций в строительстве: гипс и алебастр ОВР
ОВР Презентация на тему Альдегиды, свойства, получение, применение
Презентация на тему Альдегиды, свойства, получение, применение  Центробежное осаждение
Центробежное осаждение Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Теория валентных связей
Теория валентных связей Положительно (+) заряженные частицы. Катионы
Положительно (+) заряженные частицы. Катионы Периодическая система химических элементов. Периоды. Группы
Периодическая система химических элементов. Периоды. Группы Презентация на тему Альдегиды (10 класс)
Презентация на тему Альдегиды (10 класс)  Презентация на тему Классификация химических реакций
Презентация на тему Классификация химических реакций  Закон сохранения массы. 11 класс
Закон сохранения массы. 11 класс Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Оксиды углерода
Оксиды углерода Жиры. Строение жиров
Жиры. Строение жиров Производство полимеров в РК
Производство полимеров в РК теория строения
теория строения Магнитный момент атома. Периодическая система элементов Д.И. Менделеева
Магнитный момент атома. Периодическая система элементов Д.И. Менделеева Лекция1Тов
Лекция1Тов Типы химических реакций в органической химии
Типы химических реакций в органической химии Атомы, молекулы и ионы
Атомы, молекулы и ионы