Содержание
- 2. Жидкий азот Жидкий азот —не взрывоопасен и не ядовит. Испаряясь, азот охлаждает очаг возгорания и вытесняет
- 3. Применение жидкого азота ; для охлаждения различного оборудования и техники; для охлаждения компонентов компьютера при экстремальном
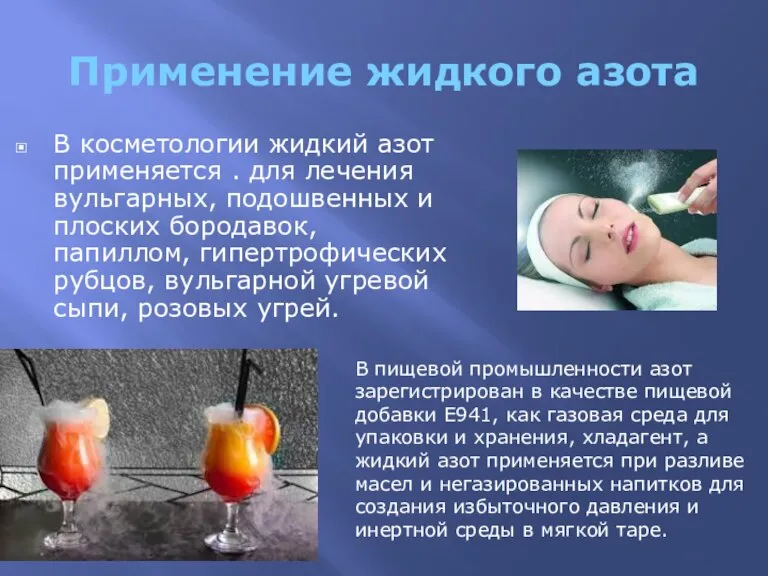
- 4. Применение жидкого азота В косметологии жидкий азот применяется . для лечения вульгарных, подошвенных и плоских бородавок,
- 5. Поведение веществ в жидком азоте Вещества в жидком азоте становятся хрупкими
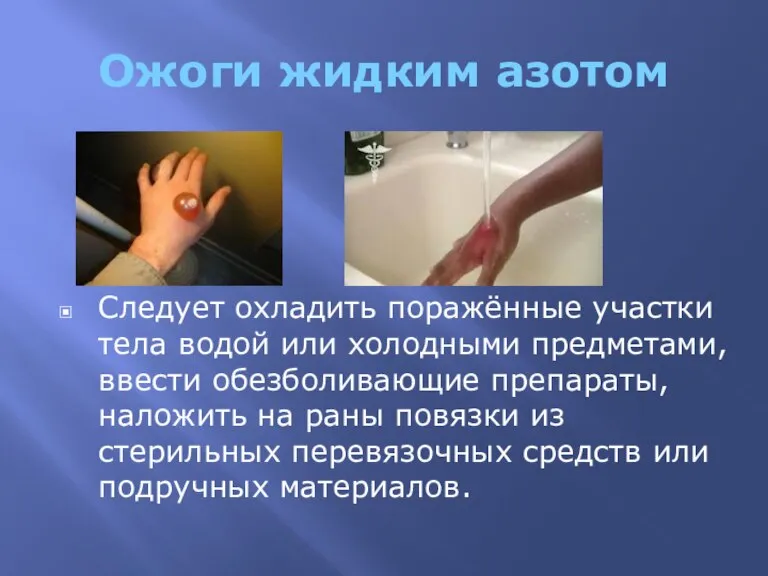
- 6. Ожоги жидким азотом Следует охладить поражённые участки тела водой или холодными предметами, ввести обезболивающие препараты, наложить
- 7. Кессонная болезнь Кессонная болезнь возникает при быстром снижении давления (например, при всплытии с глубины, выхода из
- 8. Химические свойства азота В химическом отношении азот довольно инертный газ из-за прочной ковалентной связи, атомарный же
- 9. Оксиды азота 2NO2 + H2O = HNO3 + HNO2, 4NO2 + 2H2O + О2 = 4HNO3.
- 10. Азотная кислота Температура кипения азотной кислоты +83 °С, температура замерзания –41 °С, т.е. при обычных условиях
- 11. Взаимодействие с металлами Концентрированная азотная кислота Me + HNO3(конц.) → соль + вода + NO2 С
- 12. Взаимодействие с металлами Разбавленная азотная кислота Продукт восстановления азотной кислоты в разбавленном растворе зависит от активности
- 13. Получение азотной кислоты NaNO3 + H2SO4 = NaHSO4 + HNO3 4NH3 + 5O2 → 4NO +
- 14. Применение азотной кислоты Производство азотных и комплексных удобрений. Производство взрывчатых веществ. Производство красителей. Производство лекарств. Производство
- 15. Аммиак . Аммиа́к— NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом
- 16. Аммиак - опасен В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака
- 17. Получение аммиака лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑ +
- 18. Химические свойства аммиака NH3 – сильный восстановитель. 1. Горение аммиака (при нагревании) 4NH3 + 3O2 →
- 19. ВЗАИМОДЕЙСТВИЕ АММИАКА С ВОДОЙ И КИСЛОТАМИ И водный раствор аммиака, и соли аммония содержат особый ион
- 21. Скачать презентацию
















 Оксиды и гидроксиды
Оксиды и гидроксиды Классификация неорганических веществ. Оксиды
Классификация неорганических веществ. Оксиды Маска откройся
Маска откройся Галогены элементы VII – А группы
Галогены элементы VII – А группы Непредельные углеводороды
Непредельные углеводороды Лекция1Тов
Лекция1Тов Истина - дочь времени, а не авторитета
Истина - дочь времени, а не авторитета 4_10.1С Аммиак, производство и применение_Презентация
4_10.1С Аммиак, производство и применение_Презентация Влияние инициаторов на реакцию полимеризации стирола
Влияние инициаторов на реакцию полимеризации стирола Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Биопластик на основе лигнина
Биопластик на основе лигнина Периодический закон, 9 класс (1)
Периодический закон, 9 класс (1) Растворы, растворимость
Растворы, растворимость Призер муниципального єтапа всероссийской олимпиады школьников по химии Карасева Светлана
Призер муниципального єтапа всероссийской олимпиады школьников по химии Карасева Светлана Вуглеводи. Групи
Вуглеводи. Групи Свойства бензола
Свойства бензола Разветвленные цепные реакции
Разветвленные цепные реакции Спирты и фенолы
Спирты и фенолы Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Аттестационная работа. Музей минералов и горных пород
Аттестационная работа. Музей минералов и горных пород Химическая коррозия
Химическая коррозия Формулы оксидов
Формулы оксидов Строение атома
Строение атома Для чего нужна нефть
Для чего нужна нефть Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ История открытия водорода. Получение и физические свойства водорода
История открытия водорода. Получение и физические свойства водорода Презентация на тему День Земли, Воды и Чистого воздуха
Презентация на тему День Земли, Воды и Чистого воздуха  Нафтены и арены
Нафтены и арены