Слайд 2НЕМНОГО ИСТОРИИ
Известно, что уже в конце XV в. алхимик Василий Валентин и

в XVI в. Андреас Либавий в усердных поисках чудодейственного жизненного эликсира прокаливали в своих странных для нас алхимических приборах поваренную соль с квасцами и купоросами и получили продукт, который описали под названием «кислого спирта». Это и была знакомая теперь нам кислота, конечно, очень нечистая.
Для первых исследователей это было совершенно новое вещество, обладавшее свойствами, которые сильно поражали их воображение. Нюхая его, они задыхались и кашляли, «кислый спирт» дымил в воздухе. При пробование на вкус, он обжигал язык и нёбо, металлы он разъедал, ткани разрушал.
Слайд 4Строение молекулы
Физические свойства
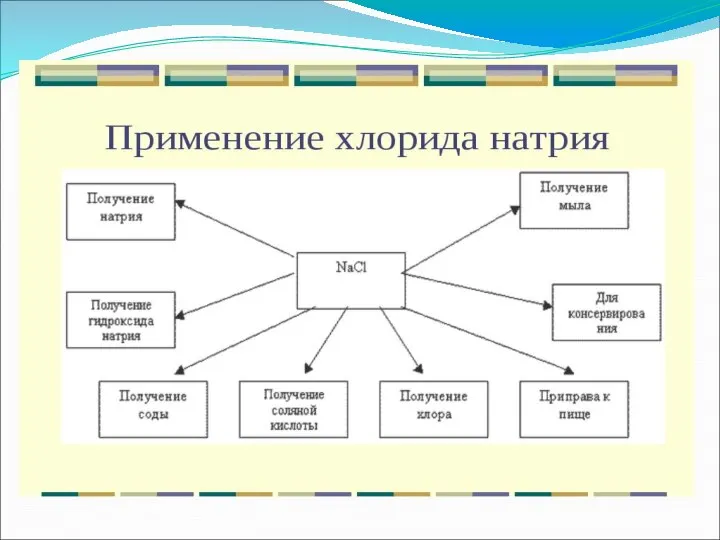
Получение
Химические свойства
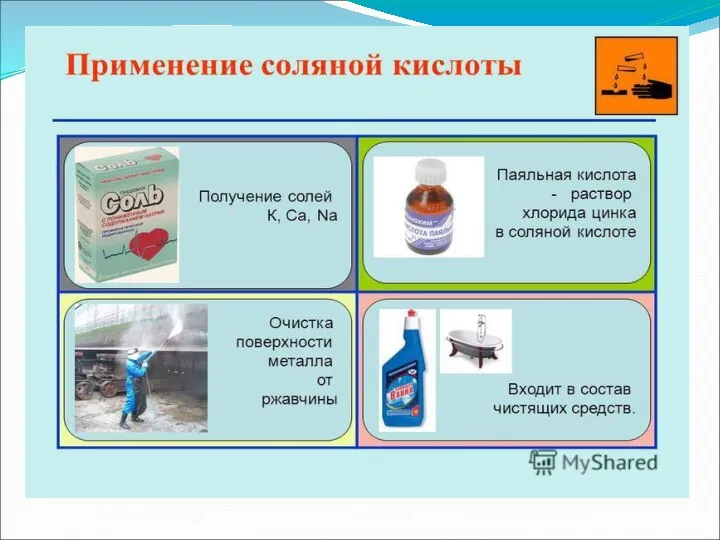
Применение

Слайд 5Физические свойства
Соля́ная кислота́ (также хлороводоро́дная, хлористоводоро́дная кислота, хлористый водород) — раствор хлороводорода (HCl) в воде,

сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.).
Слайд 7Химические свойства
Изменение окраски индикаторов
Взаимодействие с металлами
Zn + HCl –
Взаимодействие с основными и

амфотерными оксидами
CaO + HCl -
Взаимодействие с основаниями
Сu(OH)2 + HCl -
Взаимодействие с cолями
K2CO3 + HCl -
Слайд 8Специфические свойства
Качественной реакцией на соляную кислоту и её соли является её взаимодействие

с нитратом серебра, при котором образуется творожистый осадок хлорида серебра, нерастворимый в азотной кислоте
Слайд 10Это интересно
Немногие знают о том, что для улучшения и модернизации многих процессов

в строительстве используется соляная кислота. Ее добавляют в бетон для повышения его морозостойкости. К тому же, состав намного быстрее застывает, а кладка приобретает устойчивость к влаге. Еще кислоту используют в качестве окислителя от известняка.











 Презентация на тему В мире индикаторов - исследовательская работа
Презентация на тему В мире индикаторов - исследовательская работа  Бензилиденкетоны в синтезе замещённых бензимидазолопиримидинов
Бензилиденкетоны в синтезе замещённых бензимидазолопиримидинов Мемо-химия. Защита проекта
Мемо-химия. Защита проекта Периодическая система химических элементов. Дмитрий Иванович Менделеев
Периодическая система химических элементов. Дмитрий Иванович Менделеев Химия. Витамин В12
Химия. Витамин В12 Количество вещества - моль
Количество вещества - моль Наноматеріали. Тіт Лукрецій Кар
Наноматеріали. Тіт Лукрецій Кар Плотность вещества
Плотность вещества Турнир знатоков. Интеллектуальная игра
Турнир знатоков. Интеллектуальная игра Презентация на тему Чистые вещества и смеси. Химический диктант
Презентация на тему Чистые вещества и смеси. Химический диктант  Химическая организация клетки
Химическая организация клетки Валентные возможности атомов элементов
Валентные возможности атомов элементов Непредельные углеводороды. Алкадиены. Уроки 22-23
Непредельные углеводороды. Алкадиены. Уроки 22-23 Классификация реакций. Таблица
Классификация реакций. Таблица Получение аминов
Получение аминов Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего Вода. Строение молекулы. Водородная связь. Физические и химические свойства
Вода. Строение молекулы. Водородная связь. Физические и химические свойства Презентация на тему Электролиты
Презентация на тему Электролиты 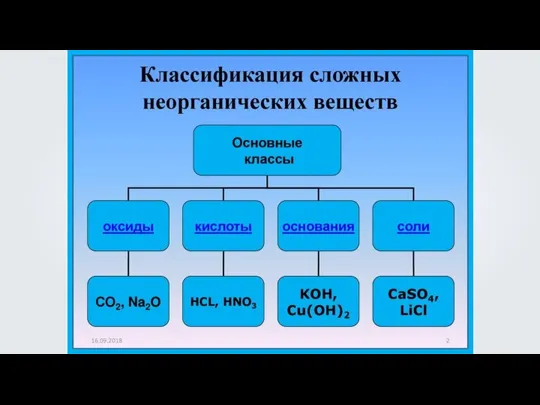 Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Čo sú chemické reakcie
Čo sú chemické reakcie Скорость химической реакции
Скорость химической реакции Glin
Glin Нафтены и арены
Нафтены и арены Действие фермента каталазы на пероксид водорода
Действие фермента каталазы на пероксид водорода ОВР химияПрезентация
ОВР химияПрезентация Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Вспомни… СаО, SО2, Fе2О3 , Nа2О, Сl2О7
Вспомни… СаО, SО2, Fе2О3 , Nа2О, Сl2О7 Синтез метилового эфира цинкофорина
Синтез метилового эфира цинкофорина