Содержание
- 2. Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность
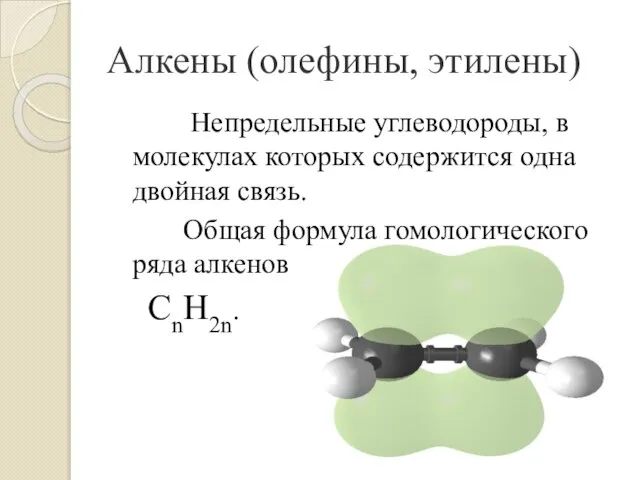
- 3. Непредельные углеводороды, в молекулах которых содержится одна двойная связь. Общая формула гомологического ряда алкенов CnH2n. Алкены
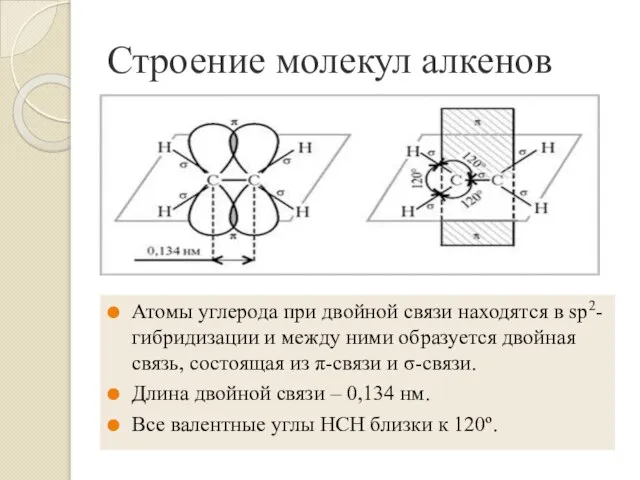
- 4. Строение молекул алкенов Атомы углерода при двойной связи находятся в sp2-гибридизации и между ними образуется двойная
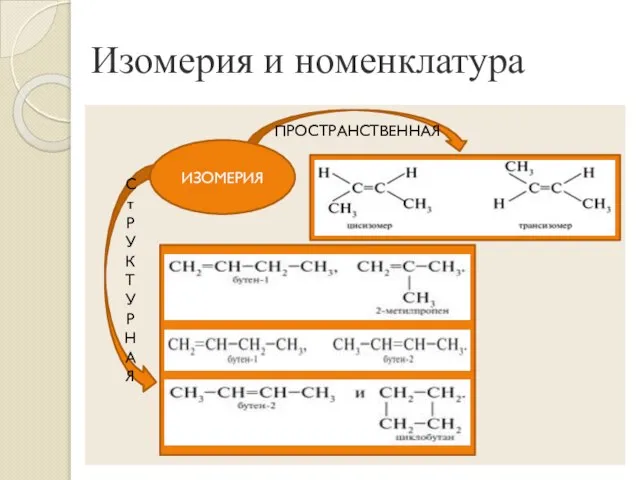
- 5. Изомерия и номенклатура С т Р У К Т У Р Н А Я ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ
- 6. Тестовое задание № 1: 1. Ациклические углеводороды, в молекулах которых содержится одна двойная связь, называются А)
- 7. Химические свойства \ σ / \ σ / C==C + A—B → C — C /
- 8. Реакции присоединения Присоединение водорода: Н2С=СН2 + H2 → Н3С—СН3 Присоединение галогенов: Н2С=СН2 + Cl2 → ClH2C—CH2Cl
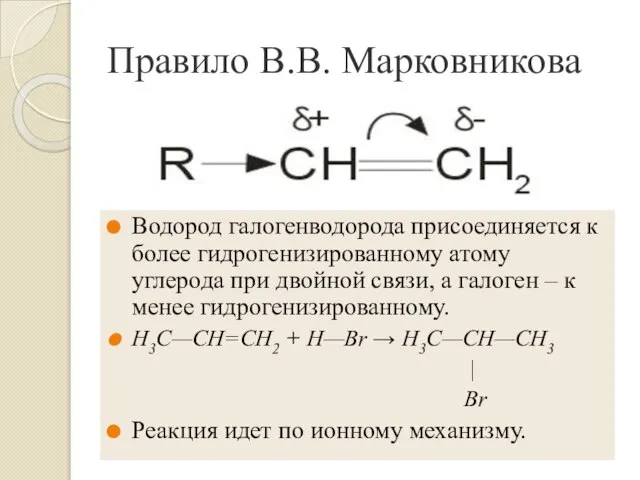
- 9. Правило В.В. Марковникова Водород галогенводорода присоединяется к более гидрогенизированному атому углерода при двойной связи, а галоген
- 10. Реакции окисления Горение: Н2С=СН2 + 3O2 → 2СO2 + 2Н2O Окисление перманганатом калия: 3H2C=CH2 + 2KMnO4
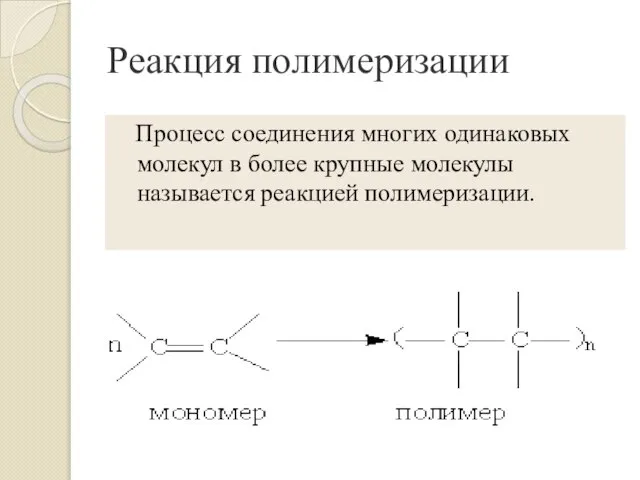
- 11. Реакция полимеризации Процесс соединения многих одинаковых молекул в более крупные молекулы называется реакцией полимеризации.
- 12. Тестовое задание № 2: 1. Реакция присоединения водорода называется А) гидрирование Б) гидрогалогенирование В) гидратация В)
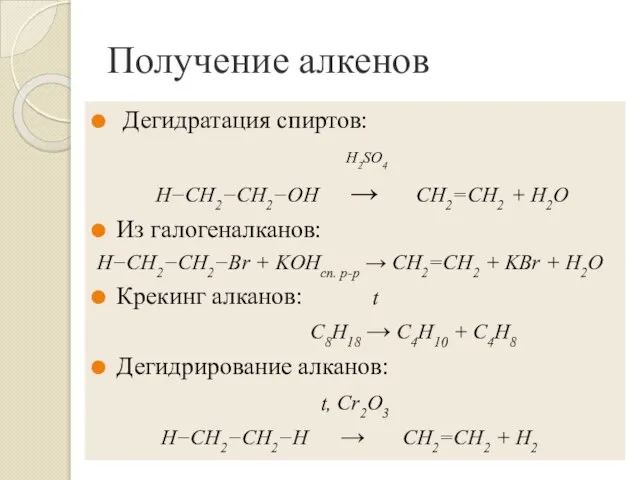
- 13. Получение алкенов Дегидратация спиртов: H2SO4 H−CH2−CH2−OH → CH2=CH2 + H2O Из галогеналканов: H−CH2−CH2−Br + KOHсп. р-р
- 14. Тестовое задание № 3: 1. Бутен можно получить крекингом: А) бутана Б) пентана В) гексана Г)
- 16. Скачать презентацию







 Строение и физические свойства металлов
Строение и физические свойства металлов Биологическая роль III(A) группы
Биологическая роль III(A) группы Валентность. Что же это такое?
Валентность. Что же это такое?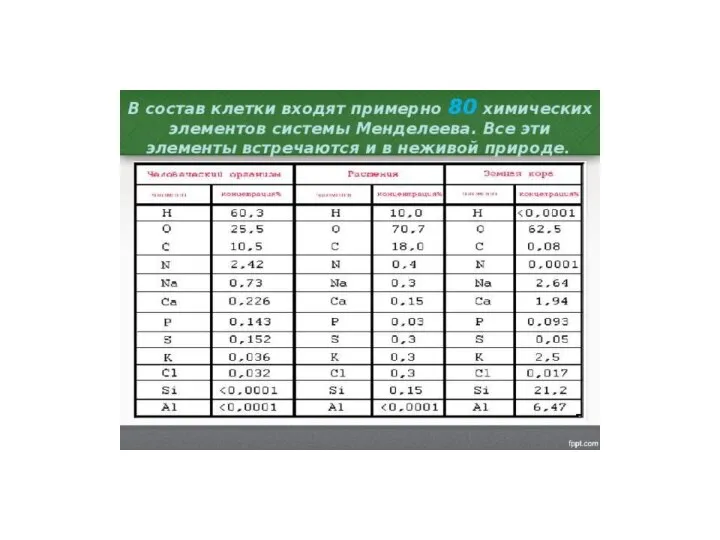 Состав клетки
Состав клетки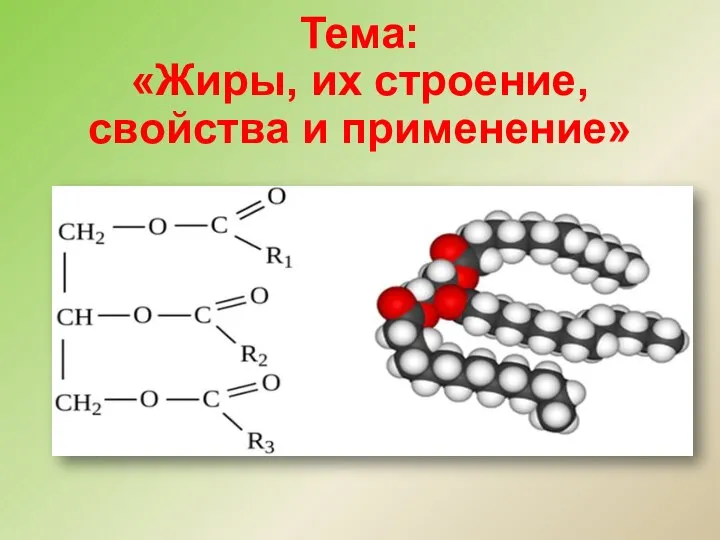 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Изучение свойств анилина. Лабораторная работа №18
Изучение свойств анилина. Лабораторная работа №18 Разнообразие жизни на Земле - Презентация_
Разнообразие жизни на Земле - Презентация_ Продолжение истории: 1933 год, Ленинград (Питер)
Продолжение истории: 1933 год, Ленинград (Питер) Смеси: гетерогенные, гомогенные
Смеси: гетерогенные, гомогенные Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Степень окисления
Степень окисления Основы химии полимеров
Основы химии полимеров Тренажер. Химические свойства солей
Тренажер. Химические свойства солей Презентация на тему Мыло. Синтетические моющие средства
Презентация на тему Мыло. Синтетические моющие средства  Строение и свойства циклоалканов
Строение и свойства циклоалканов Биодизельное топливо
Биодизельное топливо Соли: классификация, получение, номенклатура
Соли: классификация, получение, номенклатура Классификация химических реакций
Классификация химических реакций Средства для мытья окон
Средства для мытья окон Алхимики в Средние века
Алхимики в Средние века Алканы. Химические свойства. Применение
Алканы. Химические свойства. Применение Многоатомные спирты
Многоатомные спирты Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов proekt_TTU_15 (1)
proekt_TTU_15 (1) Атомы. Нахождение в природе
Атомы. Нахождение в природе Кремний и его соединения
Кремний и его соединения