Содержание
- 22. Понятие свободной энергии, энтальпии и энтропии. Первое и второе начала термодинамики. Направление процесса, сопряженные реакции, механизмы,
- 23. Термодинамика – наука, изучающая наиболее общие законы превращения различных видов энергии в системе. Под термодинамической системой
- 24. Совокупность всех значений термодинамических параметров, необходимых для описания системы, определяет термодинамическое состояние. Различают термодинамику равновесных систем
- 25. Термодинамические процессы – это процессы обмена энергией и веществом или переход энергии из одной формы в
- 26. Живая система представляет собой объект диаметрально противоположный обычным объектам классической термодинамики: это – неравновесная открытая система
- 27. Живая система, в отличие от неживых машин и механизмов, состоит не из твердых, а из мягких
- 28. Термодинамическое определение энтропии Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом. Он определил изменение
- 29. Энтропия согласно термодинамическому определению определена вплоть до произвольной аддитивной постоянной. Третье начало термодинамики позволяет определить её
- 30. Понятие энтальпии Энтальпи́я, также тепловая функция и теплосодержание —термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии
- 31. Энергия Гиббса ( “свободная энергия”) - изобарно-изотермический потенциал, связанный с энтальпией и энтропией соотношением : G
- 32. Первый закон термодинамики является законом сохранения энергии. Он определяет энергетический баланс в закрытой системе. Существует несколько
- 33. Второе начало термодинамики Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла
- 34. dS=dQ'/T+dQ/T dQ'/T – тепло в самой системе dQ/T – тепло, которым система может обмениваться со средой
- 35. Третье начало термодинамики Третье начало термодинамики - закон термодинамики, сформулированный В. Нерстом в 1906 году (тепловой
- 36. Следствия первого и второго законов термодинамики Тепловой эффект реакции не зависит от пути реакции, а только
- 37. Принцип Онзагера Для закрытой системы (то есть, не обменивающейся энергией с внешней средой) при возможности развития
- 38. Фундаментальными работами И.Р.Пригожина установлено, что вся термодинамика делится на три большие области: 1) равновесную, в которой
- 39. Гомеостаз На основании работ Пригожина появилась возможность сформулировать единую точку зрения на эволюцию, объединяющим принципом которой
- 40. Направление процесса и сопряженные реакции Направление химической реакции определяется значением ΔG. Если эта величина отрицательна, то
- 41. Механизмы, обеспечивающие протекание сопряженных реакций. Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата является эндергонической: (1)
- 42. Свободная энергия гидролиза некоторых органических фосфатов
- 43. АТФ - молекула, богатая энергией, поскольку она содержит две высокоэнергетические (макроэргические) фосфоангидридные связи (β, γ). Они
- 44. Некоторые биосинтетические реакции в организме могут протекать при участии других нуклеозидтрифосфатов, аналогов АТФ; к ним относят
- 45. Биологическое окисление Под окислением понимают отщепление электронов, а под восстановлением - присоединение электронов. Окисление донора электронов
- 46. Стандартные окислительно-восстановительные потенциалы некоторых сопряжённых пар Величину Еº' выражают в вольтах; чем она меньше (отрицательнее), тем
- 47. Основные этапы трансформации энергии катаболических процессов Энергия освобождается в процессе ферментативного окисления метаболитов специфическими дегидрогеназами. В
- 49. Скачать презентацию
Слайд 22Понятие свободной энергии, энтальпии и энтропии. Первое и второе начала термодинамики.
Направление процесса,
Направление процесса,

Стационарное состояние неравновесной системы, теорема Пригожина, принцип Онзагера, гомеостаз.
Слайд 23Термодинамика – наука, изучающая наиболее общие законы превращения различных видов энергии в
Термодинамика – наука, изучающая наиболее общие законы превращения различных видов энергии в

Под термодинамической системой понимают часть пространства, ограниченную (условно) поверхностью (оболочкой), при этом размеры частиц, составляющих систему , должны быть существенно меньше самой системы
Различают 3 типа систем:
Изолированная – не обменивается с окружающей средой ни веществом, ни энергией.
Замкнутая (закрытая) – обменивается с окружающей средой только энергией.
Открытая – обменивается с окружающей средой энергией и веществом.
Термодинамическим контактом называется такая связь между системами, при которой возможен хотя бы один из следующих типов взаимодействий.
1. Механическое взаимодействие — взаимодействие, при котором одна система совершает работу над другой системой с помощью механических, электромагнитных или иных сил.
2. Тепловое взаимодействие — взаимодействие, которое приводит к изменению энергии и происходит в форме передачи теплоты посредством теплопроводности или тепловой радиации.
3. Материальное взаимодействие — взаимодействие, которое приводит к обмену веществом между двумя системами, например взаимодействие через полупроницаемую мембрану или поверхность тела человека
Слайд 24Совокупность всех значений термодинамических параметров, необходимых для описания системы, определяет термодинамическое состояние.
Совокупность всех значений термодинамических параметров, необходимых для описания системы, определяет термодинамическое состояние.

Функцией состояния называется такая физическая характеристика системы, изменение которой при переходе системы из одного состояния в другое определяется значениями параметров начального и конечного состояний и не зависит от того, каким образом совершается этот переход. Функциями состояния являются внутренняя энергия, энтальпия, энтропия, свободная энергия Гельмгольца, термодинамический потенциал Гиббса, химический и электрохимический потенциалы.
Уравнением состояния называется функциональное соотношение между термодинамическими параметрами системы, находящейся в равновесии
Равновесным называется такое состояние системы, когда ее параметры не меняются с течением времени. Интенсивные параметры одинаковы во всех точках системы, т.е. градиенты этих параметров отсутствуют.
Неравновесным называется такое состояние системы, когда ее параметры меняются с течением времени. Интенсивные параметры различны в разных точках системы, т.е. имеются градиенты этих параметров.
Слайд 25Термодинамические процессы – это процессы обмена энергией и веществом или переход энергии
Термодинамические процессы – это процессы обмена энергией и веществом или переход энергии

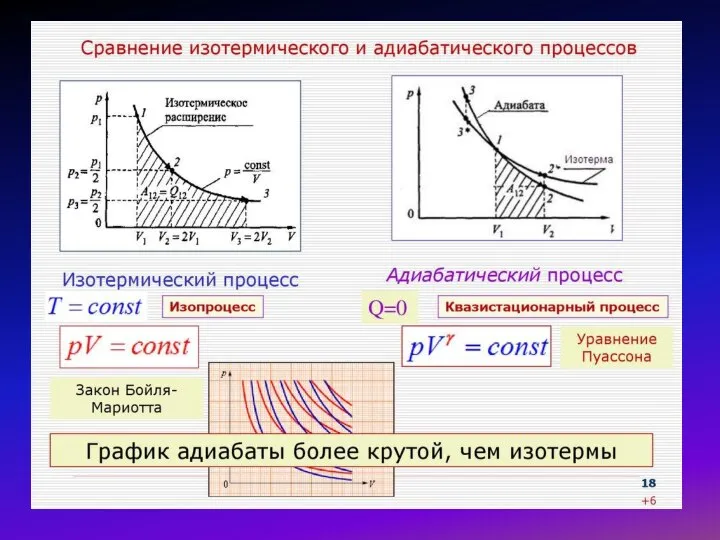
При обратимом процессе переход от начального к конечному состоянию, и наоборот, не требует дополнительных затрат энергии. Энергия переходит из одного вида к другому без потерь. Характеризует идеальные процессы.
При необратимом процессе переход от конечного состояния к начальному требует дополнительных затрат энергии, так как процессы идут с частичными потерями энергии в виде тепла. Характеризует реальные процессы.
Равновесный, или квазистатический термодинамический процесс происходит в том случае, если внешние условия изменяются так медленно, что в любой момент времени систему можно считать равновесной.
Процесс называется обратимым, если он может быть проведен в обратном направлении, причем система будет проходить в обратном порядке через те же состояния, что и прямом процессе; в противном случае процесс называется необратимым.
Обратимые процессы являются квазистатическими, но обратное утверждение не всегда верно. Например, бесконечно медленное расширение газа в пустоту является квазистатическим, но необратимым процессом. Все реальные процессы необратимы; обратимые процессы являются физической идеализацией.
Слайд 26Живая система представляет собой объект диаметрально противоположный обычным объектам классической термодинамики: это
Живая система представляет собой объект диаметрально противоположный обычным объектам классической термодинамики: это

Действительно, в основе энергетики живых систем лежит экзотермическая реакция окисления глюкозы: C6H12O6 + 6 O2 = 6 CO2 + 6 H2O + Q0 (2,86 МДж/М) (1)
Часть выделенной в организме энергии используется для совершения полезной работы. КПД её преобразования в тепловом цикле лимитируется теоремой Карно:
η ≤ (T1–T2)/T1
Перепад температуры в организме не превышает 100С. Следовательно, η ≤ 1/300 = 0,3 %. А фактически измеренный η для мышечного аппарата ≈50 %! Вот первое проявление разрыва между развитым аппаратом классической термодинамики и потребностью физики живых систем.
Значит живой организм работает не по принципу тепловой машины, η в данном случае лимитируется другими соотношениями. !!!.
Всякий же переход свободной энергии реакции (1) в тепло – это безвозвратная потеря свободной энергии, ибо обратное преобразование тепловой энергии в работу действительно лимитируется очень жесткими условиями
Т1 – температура нагревателя,
Т2 – температура холодильника в абсолютной шкале
Слайд 27Живая система, в отличие от неживых машин и механизмов, состоит не из
Живая система, в отличие от неживых машин и механизмов, состоит не из

К сожалению, многие биологические объекты относятся к самым сложным промежуточным случаям, когда они не являются ни динамической, ни термодинамической системой. Однако, вероятно, большинство биологически важных макромолекул, молекулярных комплексов, таких, как ферменты, фрагменты рибосом, митохондрий, комплексы нуклеиновых кислот с белками, могут быть описаны как машины, (типа поршень и газ) в которых долгоживущие механические степени свободы соседствуют с быстро термолизуемыми подсистемами. Распределение энергии по степеням свободы в таких объектах зависит от того, на какие именно степени свободы поступает извне свободная энергия. Можно думать, что длительная эволюция отобрала молекулярные устройства, которые обеспечивают достаточно долгую жизнь отдельных «горячих» степеней свободы, успевающих использовать кванты энергии значительно большие кТ на «полезные» акты прежде, чем они распределятся по остальным степеням свободы.
Слайд 28Термодинамическое определение энтропии
Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом.
Термодинамическое определение энтропии
Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом.

В1877 году Людвиг Больцман установил связь энтропии с вероятностью данного состояния. Позднее эту связь представил в виде формулы Макс Планк:
к=R / NA=1,38·10−23 Дж/К – постоянная Больцмана,
Ω - статистический вес состояния или число возможных микросостояний (способов), с помощью которых можно составить данное макроскопическое состояние
Статистическое определение энтропии: принцип Больцмана
Изотермический
процесс
Квазистатический
процесс
Для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния называемая энтропией, такая, что ее полный дифференциал
Слайд 29Энтропия согласно термодинамическому определению определена вплоть до произвольной аддитивной постоянной. Третье начало
Энтропия согласно термодинамическому определению определена вплоть до произвольной аддитивной постоянной. Третье начало

Согласно статистическому определению, энтропия является функцией состояния, то есть не зависит от способа достижения этого состояния, а определяется параметрами этого состояния. Так как Ω может быть только натуральным числом, то энтропия Больцмана неотрицательна исходя из свойств логарифма
Понимание энтропии как меры беспорядка:
Мы думаем об «упорядоченных» системах как о системах, имеющих очень малую возможность конфигурирования, а о «беспорядочных» системах как об имеющих очень много возможных состояний
В химических системах энтропийному фактору действующему в направлении
дезагрегации частиц и рассеяния вещества, противостоит энтальпийный фактор ∆Н,
действующий в направлении агрегации частиц, реализации сил химической связи и
межмолекулярного взаимодействия, сведения запаса энергии системы к минимуму
Изменение энтропии системы в результате химической реакции (∆S) равно сумме
энтропий продуктов реакции за вычетом суммы энтропий исходных веществ.
∆S х.р. = Σ∆ Sопр. - Σ∆ Sоисх. в-в
Слайд 30Понятие энтальпии
Энтальпи́я, также тепловая функция и теплосодержание —термодинамический потенциал, характеризующий состояние системы в
Понятие энтальпии
Энтальпи́я, также тепловая функция и теплосодержание —термодинамический потенциал, характеризующий состояние системы в

H=E = U + pV
Энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии.
Стандартным состоянием вещества называется его состояние в виде чистого вещества при давлении, равном нормальному атмосферному давлению (101,325 кПа или 760 мм рт.ст.) и температуре Т=298,15К. Отнесенные к этим условиям изменения соответствующих величин называются стандартными изменениями и их обозначения снабжаются верхним индексом о:
∆Н о– стандартное изменение энтальпии при химической реакции.
Стандартное изменение энтальпии химической реакции (тепловой эффект) равно
сумме стандартных энтальпий образования продуктов реакции за вычетом суммы
стандартных энтальпий образования исходных веществ.
∆Нор = Σ∆Н о пр. - Σ∆Н оисх.вещ-в
Слайд 31Энергия Гиббса ( “свободная энергия”) - изобарно-изотермический потенциал, связанный с энтальпией и
Энергия Гиббса ( “свободная энергия”) - изобарно-изотермический потенциал, связанный с энтальпией и

G = H – TS , где Т- абсолютная температура.
Для изобарно-изотермических процессов (то есть процессов, протекающих при
постоянных температуре и давлении) изменение энергии Гиббса равно:
∆G = ∆H – T ∆S
Понятие свободной энергии
При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия
Гиббса системы уменьшается (∆G <0). Абсолютное значение разности ∆H – T∆S определяет движущую силу этого процесса
При низких температурах наиболее вероятно самопроизвольное протекание экзотермических реакций (∆Н <0), если при этом энтропия системы уменьшается. При высоких температурах, наиболее вероятно протекание реакций, сопровождающихся возрастанием энтропии, в том числе и эндотермических реакций.
Слайд 32Первый закон термодинамики является законом сохранения энергии. Он определяет энергетический баланс в
Первый закон термодинамики является законом сохранения энергии. Он определяет энергетический баланс в

Первое начало термодинамики
В любой изолированной системе запас энергии остаётся постоянным.[2]
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход.
Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты , сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества при химическом потенциале, и работы, совершённой над системой внешними силами и полями, за вычетом работы, совершённой самой системой против внешних сил.
при изобарном процессе
5) В дифференциальной форме первый закон термодинамики выглядит так:
dU=δQ±δA ,
где Q и A – сообщенное тепло и совершаемая работа, не являются функциями состояния, так как это функции процесса, поэтому они не имеют полного дифференциала.
Слайд 33Второе начало термодинамики
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление
Второе начало термодинамики
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление

Существуют несколько эквивалентных формулировок :
В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара (Кельвина)
Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему (Клаузиуса)]
Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара (Томсона)
Любой самопроизвольный процесс может протекать в изолированной системе лишь в том случае, когда он характеризуется увеличением энтропии; в равновесии энтропия системы постоянна (Закон неубывания энтропии): ΔS≥ 0.
На основе энергии Гиббса второе начало термодинамики можно сформулировать следующим образом: в изобарно-изотермических условиях (р,Т = const) в системе самопроизвольно могут осуществляться только такие процессы, в результате которых энергия Гиббса системы уменьшается (ΔG <0).В состоянии равновесия энергия Гиббса системы не меняется (G = const, AG = 0)
Слайд 34dS=dQ'/T+dQ/T
dQ'/T – тепло в самой системе
dQ/T – тепло, которым система может обмениваться
dS=dQ'/T+dQ/T
dQ'/T – тепло в самой системе
dQ/T – тепло, которым система может обмениваться

diS=dQ'/T – внутренний источник энтропии
deS=dQ/T – внешний источник энтропии
dS=diS+deS
diS>0 – необратимые процессы
dS/dt=diS/dt+deS/dt
Скорость изменения энтропии в системе равна сумме скорости продукции энтропии в самой системе и скорости обмена энтропией между системой и окружающей средой.
Скорость продукции энтропии в системе всегда больше 0, так как т/д процессы в ней необратимы.
Энтропия в открытой системе изменяется за счет процессов производства энтропии в самой системе и за счет обмена энтропии между системой и окружающей средой.
1. Второй закон т/д был сформулирован для характеристики изолированных систем. Реальные биологические системы являются открытыми.
2. Значение энтропии строго определено для равновесного состояния. Биосистемы в своем развитии проходят через целый ряд неравновесных состояний.
Применимость второго закона термодинамики для характеристики свойств биосистем
Слайд 35Третье начало термодинамики
Третье начало термодинамики - закон термодинамики, сформулированный В. Нерстом в
Третье начало термодинамики
Третье начало термодинамики - закон термодинамики, сформулированный В. Нерстом в

Макс Планк в 1911 году дал другую формулировку третьего начала термодинамики - как условие обращения в нуль энтропии всех тел при стремлении температуры к абсолютному нулю:
Формулировка Планка соответствует определению энтропии в статистической физике через термодинамическую вероятность (W) состояния системы S = klnW.
При абсолютном нуле температуры система находится в основном квантово-механическом состоянии, если оно невырожденно, для которого W = 1 (состояние реализуется единственным микрораспределением). Следовательно, энтропия S при Т = 0 равна нулю. В действительности при всех измерениях стремление энтропии к нулю начинает проявляться значительно раньше, чем может стать существенной при T → 0 дискретность квантовых уровней макроскопической системы, приводящая к явлениям квантового вырождения
Слайд 36Следствия первого и второго законов термодинамики
Тепловой эффект реакции не зависит от пути
Следствия первого и второго законов термодинамики
Тепловой эффект реакции не зависит от пути

Необратимый процесс всегда сопровождается рассеянием энергии в тепло TdS
Если dF < 0 или dG < 0 , то процесс самопроизвольный и необратим, если dF >0 и dG > 0 , то процесс несамопроизвольный и обратимый При достижении равновесия F и G →min . , а dF и dG = 0 .
Все вышеизложенное разработано для закрытых и изолированных систем, находящихся в состоянии термодинамического равновесия. При этом состоянии, когда S = max.,F = 0,G = 0,∆ S = 0, ∆ F = 0, ∆ G = 0 , процессы не протекают, материя мертва, так как система не может самопроизвольно выйти из этого состояния.
Живые системы находятся в стационарном состоянии. При этом скорость протекания процессов остается постоянной, то есть ∆ S , ∆ F, ∆ G ≈0 , но F и G> 0, а S
Слайд 37Принцип Онзагера
Для закрытой системы (то есть, не обменивающейся энергией с внешней средой)
Принцип Онзагера
Для закрытой системы (то есть, не обменивающейся энергией с внешней средой)

Позже Илья Пригожин (лауреат Нобелевской премии по химии за 1977 год «за работы по термодинамике необратимых процессов, и прежде всего за создание теории диссипативных структур») показал, что эта теорема не выполняется для систем, активно обменивающихся энергией с внешней средой, в которых действует принцип «порядок через флуктуацию»: при притоке вещества и/или энергии из окружающего пространства в достаточно сложную среду, в ней возможно образование новых так называемых диссипативных структур.
Переходы между двумя конфигурациями (классами конфигураций) А и В должны
происходить в прямом и обратном направлении в заданный промежуток времени с
одинаковой частотой. Это утверждение, по сути, есть не что иное, как принцип детального равновесия, который является одним из основных положений химической кинетики.
Основы неравновесной линейной термодинамики заложены Онзагером и развиты Пригожиным. Согласно ее положениям, допускается, что, даже если система в целом не равновесна, каждая из подсистем может находиться в состоянии равновесия (принцип локального равновесия).
Слайд 38Фундаментальными работами И.Р.Пригожина установлено, что вся термодинамика делится на три большие области:
Фундаментальными работами И.Р.Пригожина установлено, что вся термодинамика делится на три большие области:

1) равновесную, в которой производство энтропии, потоки и силы равны нулю,
2) Слабо неравновесную, в которой термодинамические силы «слабы», и энергетические потоки линейно зависят от сил,
3) сильно неравновесную, или нелинейную, где энергетические потоки нелинейны, а все термодинамические процессы носят необратимый характер
Стационарное состояние неравновесной системы, теорема Пригожина
Неравновесная термодинамика подразделяется на линейную и нелинейную.
Линейная рассматривает процессы, протекающие вблизи равновесия.
Нелинейная – вдали от него
Теорема Пригожина утверждает, что скорость продукции энтропии внутри открытой системы в стационарном состоянии положительна и минимальна
Следствие теоремы Пригожина
Принцип Ле-Шателье. Если термодинамическую систему вывести из состояния равновесия, в ней возникнут силы и потоки, стремящиеся вернуть систему в исходное состояние равновесия.
Слайд 39Гомеостаз
На основании работ Пригожина появилась возможность сформулировать единую точку зрения на эволюцию,
Гомеостаз
На основании работ Пригожина появилась возможность сформулировать единую точку зрения на эволюцию,

Гомеоста́з — саморегуляция, способность открытой системы сохранять постоянство своего внутреннего состояния посредством скоординированных реакций, направленных на поддержание динамического равновесия. Стремление системы воспроизводить себя, восстанавливать утраченное равновесие, преодолевать сопротивление внешней среды.
Гомеостаз, гомеостазис— относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций (кровообращения, дыхания, терморегуляции, обмена веществ и так далее) организма человека и животных. Регуляторные механизмы, поддерживающие физиологическое состояние или свойства клеток, органов и систем целостного организма на оптимальном уровне, называются гомеостатическими.
Слайд 40Направление процесса и сопряженные реакции
Направление химической реакции определяется значением ΔG. Если эта
Направление процесса и сопряженные реакции
Направление химической реакции определяется значением ΔG. Если эта

Если ΔG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эндергоническими. Если абсолютное значение ΔG велико, то система устойчива, и реакция в таком случае практически не осуществляется. При ΔG, равном нулю, система находится в равновесии
В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. Такие реакции называют энергетически сопряжёнными. Многие из этих реакций происходят при участии аденозинтрифосфата (АТФ), играющего роль сопрягающего фактора.
Слайд 41Механизмы, обеспечивающие протекание сопряженных реакций.
Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата
Механизмы, обеспечивающие протекание сопряженных реакций.
Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата

(1) Глюкоза + Н3РО4 → Глюкозо-6-фосфат + Н2О (ΔG = +13,8 кДж/моль).
Для протекания такой реакции в сторону образования глюкозо-6-фосфата необходимо её сопряжение с другой реакцией, величина свободной энергии которой больше, чем требуется для фосфорилирования глюкозы.
(2) АТФ → АДФ + Н3РО4 (ΔG = -30,5 кДж/моль).
При сопряжении процессов (1) и (2) в реакции, катализируемой гексокиназой, фосфорилирование глюкозы легко протекает в физиологических условиях; равновесие реакции сильно сдвинуто вправо, и она практически необратима:
(3) Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ (ΔG = -16,7 кДж/моль).
Слайд 42Свободная энергия гидролиза некоторых органических фосфатов
Свободная энергия гидролиза некоторых органических фосфатов

Слайд 43АТФ - молекула, богатая энергией, поскольку она содержит две высокоэнергетические (макроэргические) фосфоангидридные
АТФ - молекула, богатая энергией, поскольку она содержит две высокоэнергетические (макроэргические) фосфоангидридные
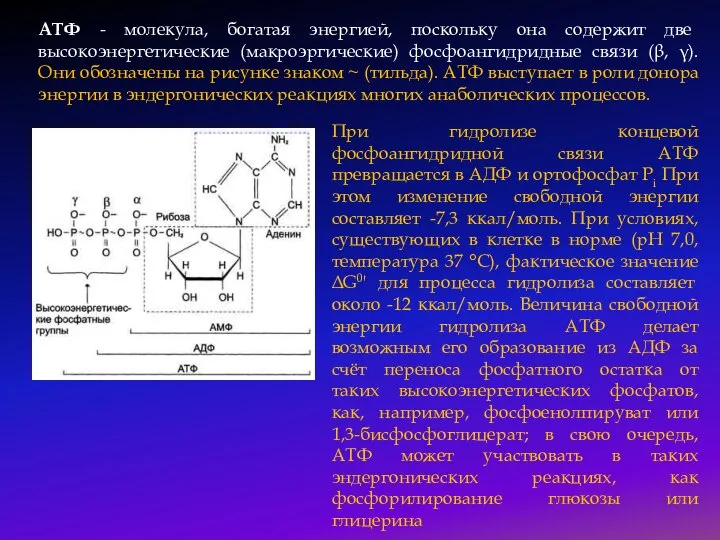
При гидролизе концевой фосфоангидридной связи АТФ превращается в АДФ и ортофосфат Рi При этом изменение свободной энергии составляет -7,3 ккал/моль. При условиях, существующих в клетке в норме (рН 7,0, температура 37 °С), фактическое значение ΔG0' для процесса гидролиза составляет около -12 ккал/моль. Величина свободной энергии гидролиза АТФ делает возможным его образование из АДФ за счёт переноса фосфатного остатка от таких высокоэнергетических фосфатов, как, например, фосфоенолпируват или 1,3-бисфосфоглицерат; в свою очередь, АТФ может участвовать в таких эндергонических реакциях, как фосфорилирование глюкозы или глицерина
Слайд 44Некоторые биосинтетические реакции в организме могут протекать при участии других нуклеозидтрифосфатов, аналогов
Некоторые биосинтетические реакции в организме могут протекать при участии других нуклеозидтрифосфатов, аналогов

Таким образом, АТФ - главный, непосредственно используемый донор свободной энергии в биологических системах. В клетке молекула АТФ расходуется в течение одной минуты после её образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч.
Использование АТФ как источника энергии возможно только при условии непрерывного синтеза АТФ из АДФ за счёт энергии окисления органических соединений. Цикл АТФ-АДФ - основной механизм обмена энергии в биологических системах, а АТФ - универсальная "энергетическая валюта".
Слайд 45Биологическое окисление
Под окислением понимают отщепление электронов, а под восстановлением - присоединение электронов.
Биологическое окисление
Под окислением понимают отщепление электронов, а под восстановлением - присоединение электронов.

Разные редокс-пары обладают различным сродством к электрону. Те, у которых это сродство меньше, отдают электрон тем, у кого оно больше. Мерой сродства редокспары к электрону служит окислительно-восстановительный потенциал, или редокс-потенциал (Е0'), величина которого непосредственно связана с изменением свободной энергии. Величину Еº' выражают в вольтах; чем она меньше (отрицательнее), тем меньше сродство вещества к электронам. Чем больше сродство, тем больше восстановительный потенциал.
Перенос электронов от окисляемых субстратов к кислороду происходит в несколько этапов. В нём участвует большое количество промежуточных переносчиков, каждый из которых способен присоединять электроны от предыдущего компонента и передавать следующему. Так возникает цепь окислительно-восстановительных реакций, в результате чего происходят восстановление О2 и синтез Н2О.
Слайд 46Стандартные окислительно-восстановительные потенциалы
некоторых сопряжённых пар
Величину Еº' выражают в вольтах; чем
Стандартные окислительно-восстановительные потенциалы
некоторых сопряжённых пар
Величину Еº' выражают в вольтах; чем

Редокс-потенциалы Е0' связаны с изменением свободной энергии уравнением Нернста
ΔG0´ = - nFΔEº´
где n - число перенесённых в реакции электронов; F - постоянная Фарадея (23 061 ккал B-1 моль-1); ΔЕо' - разность редокс-потенциалов электрондонорной и электронакцепторной пар. Величина ΔЕо' - стандартная величина окислительно-восстановительного потенциала; её определяют в стандартных условиях, когда концентрации всех веществ равны 1 М, давление газов составляет 1 атм, а рН 7,0
Слайд 47Основные этапы трансформации энергии катаболических процессов
Энергия освобождается в процессе ферментативного окисления метаболитов
Основные этапы трансформации энергии катаболических процессов
Энергия освобождается в процессе ферментативного окисления метаболитов

Окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды, называют тканевым дыханием, а цепь переноса электронов (ЦПЭ) - дыхательной цепью.
Электроны, поступающие в ЦПЭ, по мере их продвижения от одного переносчика к другому теряют свободную энергию. Значительная часть этой энергии запасается в форме АТФ, а часть энергии рассеивается в виде тепла. Кроме того, электроны с высоким энергетическим потенциалом, возникающие при окислении различных субстратов, могут быть использованы в реакциях биосинтеза, для которых помимо АТФ требуются восстановительные эквиваленты, например NADPH.


















 Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Современные химические топливные элементы
Современные химические топливные элементы Соляная кислота
Соляная кислота Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары
Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары Производство полимеров в РК
Производство полимеров в РК Химический состав клетки. Неорганические вещества
Химический состав клетки. Неорганические вещества Ацетиленди гидратациялау
Ацетиленди гидратациялау Композитные материалы
Композитные материалы Природные источники углеводородов. Домашняя работа. 10 класс
Природные источники углеводородов. Домашняя работа. 10 класс Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Легкоплавкие сплавы. Изменение свойств сплавов на технологических этапах. Адгезия
Легкоплавкие сплавы. Изменение свойств сплавов на технологических этапах. Адгезия Средства ухода за кожей
Средства ухода за кожей Химиялық фармацевтикалық техниканың үдерістері
Химиялық фармацевтикалық техниканың үдерістері Вода как хладагент (R718)
Вода как хладагент (R718) Азотосодержащие органические соединения
Азотосодержащие органические соединения Соли аммония
Соли аммония Алканы. Этан - C₂H₆
Алканы. Этан - C₂H₆ Задания на альдегиды и кетоны
Задания на альдегиды и кетоны Спирты. Общая формула, номенклатура
Спирты. Общая формула, номенклатура Химия һәм сәламәт яшәү рәвеше
Химия һәм сәламәт яшәү рәвеше Ko pēta ķīmija
Ko pēta ķīmija Общая характеристика металлов
Общая характеристика металлов Агрегатные состояния вещества
Агрегатные состояния вещества Этиленовые углеводороды (алкены, олефины)
Этиленовые углеводороды (алкены, олефины) Гомологи и изомеры
Гомологи и изомеры Винилпиридиновые каучуки
Винилпиридиновые каучуки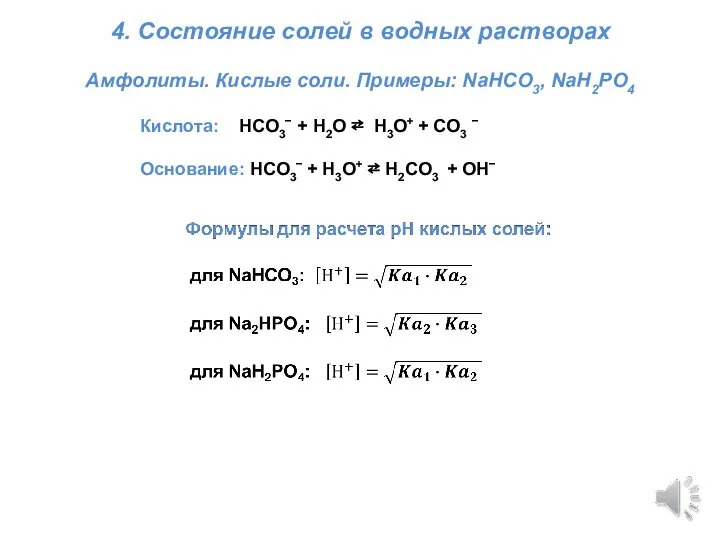 Титриметрия. Состояние солей в водных растворах
Титриметрия. Состояние солей в водных растворах Турнир знатоков. Интеллектуальная игра
Турнир знатоков. Интеллектуальная игра