Слайд 2ПЛАН ЛЕКЦИИ:
Растворы, классификация, коллигативные свойства. Закон Рауля и следствия из него.
Диффузия.

Осмос. Осмотическое давление: закон Вант-Гоффа.
Растворы электролитов. Изотонический коэффициент.
Гипо-, гипер- и изотонические растворы. Осмомоляльность и осмомолярность биологических жидкостей и перфузионных растворов. Изоосмия.
Слайд 31. Растворы, классификация, коллигативные свойства. Закон Рауля и следствия из него

Слайд 4РАСТВОРЫ
Дисперсные системы – системы, в которых одно вещество равномерно распределено в виде

частиц внутри другого вещества.
Дисперсность – раздробленность, величина обратная размеру частиц растворенного вещества.
Слайд 5В дисперсных системах различают:
дисперсную фазу – мелкораздробленное вещество;
дисперсионную среду – однородное

вещество, в котором распределена дисперсная фаза.
Слайд 6КЛАССИФИКАЦИЯ РАСТВОРОВ
По агрегатному состоянию компонентов:
– газообразные (воздух);
– жидкие;
– твердые (сплавы);
По степени

дисперсности (размеру частиц дисперсной фазы):
– ионо- и молекулярнодисперсные;
– коллоидные;
– грубодисперсные.
Слайд 7По степени дисперсности смеси веществ условно делят на:
1. Истинные растворы (ионо-

и молекулярнодисперсные)
(размер частиц меньше 1 нм, т.е. определяется размером ионов, молекул, ионных пар);
2. Коллоидные растворы
(размер частиц 1-500 нм);
3. Грубодисперсные или механические смеси (размер частиц от 1000 нм и более).
.
Слайд 8III. По содержанию растворенного вещества:
– насыщенные (растворы, в которых при данных условиях

невозможно растворить еще какое-либо количество вещества);
– ненасыщенные растворы делятся на:
1. Разбавленные (доля растворенного вещества очень мала по сравнению с растворителем);
2. Концентрированные (доля растворенного вещества в растворе велика).
Слайд 9IV. По поведению веществ в растворах:
– растворы электролитов, веществ, молекулы которых

диссоциируют на ионы (проводят электрический ток);
– растворы неэлектролитов, веществ, молекулы которых не диссоциируют на ионы (не проводят электрический ток).
Слайд 10КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ – это
свойства растворов, зависящие от концентрации компонентов, но

не зависящие от их природы:
1. Понижение давления насыщенного пара над раствором по сравнению с растворителем;
2. Повышение температуры кипения и понижение температуры замерзания (кристаллизации) растворов по сравнению с растворителем;
3. Осмотические явления.
Слайд 11
ДАВЛЕНИЕ НАСЫЩЕННОГО ПАРА. ЗАКОН РАУЛЯ
Пар, находящийся в динамическом равновесии с жидкостью называется

насыщенным и характеризуется давлением (P) (Па, атм.), (упругость пара).
Давление насыщенного пара зависит от:
– природы жидкости;
– температуры, с ростом которой давление возрастает.
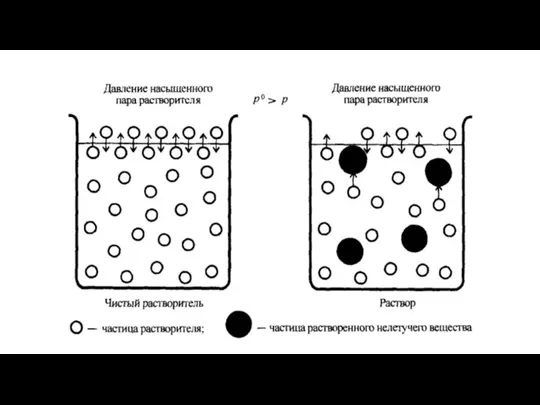
Слайд 12Добавление в растворитель растворенного вещества (нелетучего неэлектролита) приводит к снижению пара растворителя

над раствором по сравнению с давлением насыщенного пара над чистым растворителем и связано с уменьшением количества свободных молекул растворителя на поверхности жидкости.
Слайд 14Закон Рауля
Молекулы нелетучего растворенного компонента раствора препятствуют улетучиванию из раствора молекул растворителя.

Понижение давления насыщенного пара растворителя над раствором пропорционально молярной доле растворенного нелетучего вещества.
Слайд 16Следствия из закона Рауля
Повышение температуры кипения ∆Ткип и понижение температуры замерзания ∆Тзам,

разбавленных растворов неэлектролитов прямо пропорционально моляльной концентрации раствора Сm:
∆ Ткип = Кэ×Сm;
∆ Тзам = Кк×Сm.
Слайд 17Кэ – эбулиоскопическая постоянная растворителя (численно равна повышению температуры кипения одномоляльного раствора);
Кк

– криоскопическая постоянная растворителя (равна понижению температуры замерзания одномоляльного раствора).
Слайд 18Кэ и Кк
зависят от природы растворителя не зависят от природы растворенного

вещества (идеальные растворы)
Для воды: Кэ = 1,86; Кк = 0,52,
Слайд 202. Растворы электролитов.
Изотонический коэффициент

Слайд 21РАСТВОРЫ ЭЛЕКТРОЛИТОВ
При равных концентрациях растворов давление насыщенного пара растворителя над раствором электролита

ниже, чем над раствором неэлектролита той же концентрации. Диссоциация увеличивает общее число частиц растворенного вещества.
Слайд 22Изотонический коэффициент i (коэффициент Вант-Гоффа), связан со степенью диссоциации электролита ά следующим

соотношением:
i = 1 + α × (n – 1),
где n – число ионов, на которые при диссоциации распадается
электролит.
ΔТкип = i ×Кэ × Сm;
ΔТзам = i × Кк × Сm;
Росм = i × R × T × Cm.
Слайд 24ОСМОС –
процесс преимущественно одностороннего проникновения молекул растворителя через полупроницаемую мембрану.

Слайд 25ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ –
дополнительное гидростатическое давление, при котором осмос прекращается.

Слайд 26ЗАКОН ВАНТ-ГОФФА:
Осмотическое давление (Росм или π) разбавленных растворов неэлектролитов прямо пропорционально молярной

концентрации раствора и абсолютной температуре:
Росм = С×R×T,
где С – молярная концентрация раствора, моль/м3;
R – газовая постоянная (8,314 Дж/(моль×К);
Т – абсолютная температура (К).
Слайд 274. Гипо-, гипер- и изотонические растворы. Осмомоляльность и осмомолярность биологических жидкостей и

перфузионных растворов. Изоосмия
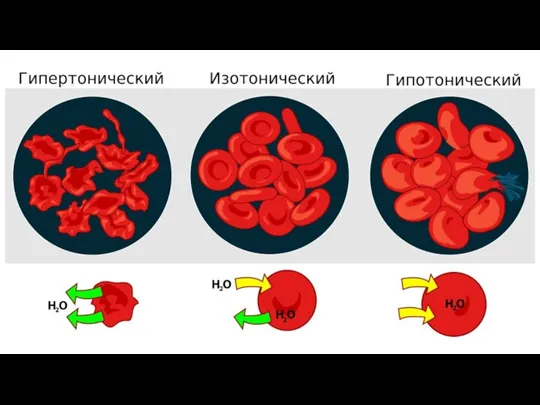
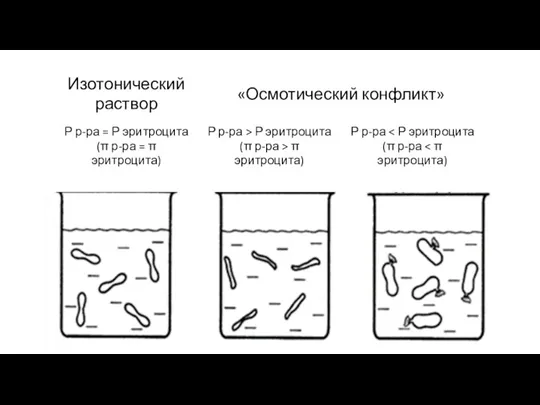
Слайд 28ИЗОТОНИЧЕСКИЕ РАСТВОРЫ – растворы с одинаковым осмотическим давлением.
ГИПЕРТОНИЧЕСКИЙ раствор имеет большее

осмотическое давление,
ГИПОТОНИЧЕСКИЙ – меньшее.
Слайд 30Осмотическое давление крови человека имеет осмолярную концентрацию 0,29-0,30 моль/л.
Изотонические (физиологические) растворы характеризуются

осмотическим давлением, равным давлению плазмы крови
(0,9 % раствор NаСI (0,15 моль/л) и 5 % раствор глюкозы (0,3 моль/л).
Слайд 31Эндоосмос – движение растворителя в осмотическую ячейку из окружающей среды.
Экзоосмос – движение

растворителя из осмотической ячейки в окружающую среду.
Слайд 32Вследствие экзоосмоса эритроциты обезвоживаются и сморщиваются – плазмолиз.
Вследствие эндоосмоса наблюдается «осмотический шок»

и может произойти разрыв эритроцитарных оболочек – гемолиз.
Слайд 34Осмолярность – осмотическое давление раствора, определяющееся суммарной концентрацией кинетически активных частиц в

единице объема раствора (мОсм/л).
Слайд 36Осмоляльность – концентрация осмотически активных частиц в растворе, выраженная количеством осмолей на

килограмм растворителя.
Осмоль – молекулярный вес вещества, разделенный на число ионов или частиц, образующихся при растворении вещества.
Слайд 37Осмоляльность плазмы крови – важнейшая константа организма человека, колеблется в незначительных пределах

(255-295 ммоль/л), зависит в основном от концентрации в крови ионов натрия, глюкозы и мочевины.
Слайд 38Изоосмия – постоянство осмотического давления.
Осмотическое давление биологических жидкостей человека довольно постоянно

и составляет 740-780 кПа (7,4-7,8 атм) при 37 °С.
Обусловлено ионами неорганических солей, в меньшей степени коллоидными частицами и молекулами белков.
Слайд 39Онкотическое давление – осмотическое давление, создаваемое молекулами белков в биожидкостях организма
(2,5-4,0

кПа).
Обеспечивает обмен воды между кровью и тканями, распределяя ее между сосудистым руслом и внесосудистым пространством.
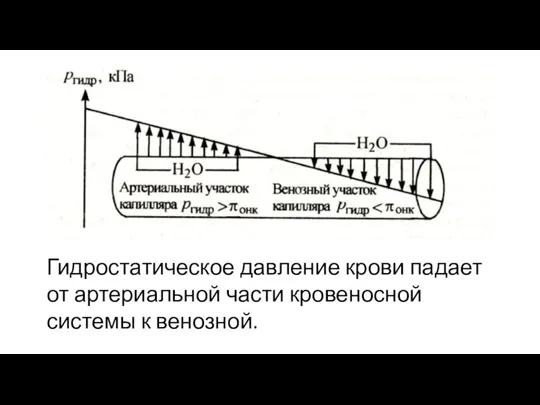
Слайд 40Гидростатическое давление крови падает от артериальной части кровеносной системы к венозной.
Слайд 41Перфузионные растворы применяют при пересадке для хранения органов и тканей.
Плазмозаменители – препараты

для парентерального питания, на основе декстрана, поливинилпирролидона, желатина и солевых растворов.





































 Великий кислород
Великий кислород Химическая термодинамика
Химическая термодинамика Оксиды, их классификация. Свойства оксидов в свете теории электролитической диссоциации
Оксиды, их классификация. Свойства оксидов в свете теории электролитической диссоциации Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Основания
Основания Химическая связь
Химическая связь Презентация на тему Целлюлоза
Презентация на тему Целлюлоза  каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами
каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами Путешествие в мир кислот
Путешествие в мир кислот Ar, Mr
Ar, Mr Аэрированный сшитый полимерный раствор (АСПР)
Аэрированный сшитый полимерный раствор (АСПР) Кислород как вещество
Кислород как вещество Пиримидин (шестичленный гетероцикл с двумя атомами азота)
Пиримидин (шестичленный гетероцикл с двумя атомами азота) Предмет органической химии. Теория химического строения органических веществ. 9 класс
Предмет органической химии. Теория химического строения органических веществ. 9 класс Окислительно-восстановительные реакции (ОВР). Лекция 1
Окислительно-восстановительные реакции (ОВР). Лекция 1 VVEDENIE_V_OGRANIChESKUYu_KhIMIYu
VVEDENIE_V_OGRANIChESKUYu_KhIMIYu Кислоты. 3 класс
Кислоты. 3 класс Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии Презентация на тему Нанотехнологии и Наноматериалы
Презентация на тему Нанотехнологии и Наноматериалы  Образование первичной структуры белка
Образование первичной структуры белка Кислоты. Начальные сведения
Кислоты. Начальные сведения Кислоты. 8 класс
Кислоты. 8 класс Углеродные материалы. Основные понятия и определения. Области их применения
Углеродные материалы. Основные понятия и определения. Области их применения Химический элемент Ferrum(2,3)
Химический элемент Ferrum(2,3) Структуры железоуглеродистых сплавов в равновесном состоянии
Структуры железоуглеродистых сплавов в равновесном состоянии Алканы
Алканы Презентация на тему Природный газ
Презентация на тему Природный газ  Презентация на тему Сплавы металлов (9 класс)
Презентация на тему Сплавы металлов (9 класс)