Содержание
- 2. Химическая формула Н2О СО2 НCl NaCl Н2SО4 C6H12О6 О2
- 3. В химии при письме вместо названий используют формулы веществ. Как вы думаете, почему? Н2О СО2 НCl
- 4. Формулы веществ записывать быстрее, они занимают мало место и несут много информации. Наша задача сегодня –
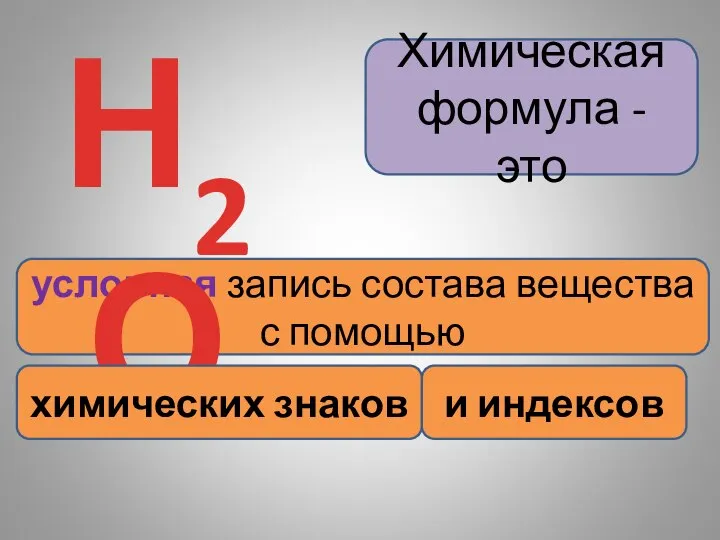
- 5. Химическая формула - это условная запись состава вещества с помощью Н2О химических знаков и индексов
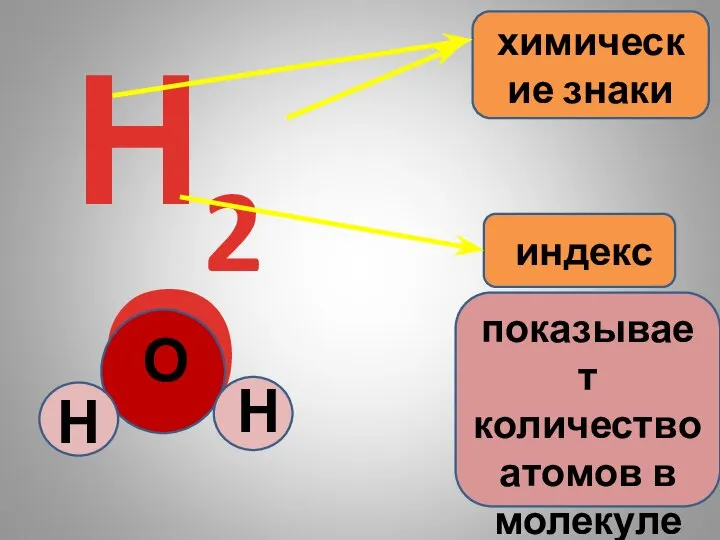
- 6. Н2О химические знаки индекс показывает количество атомов в молекуле
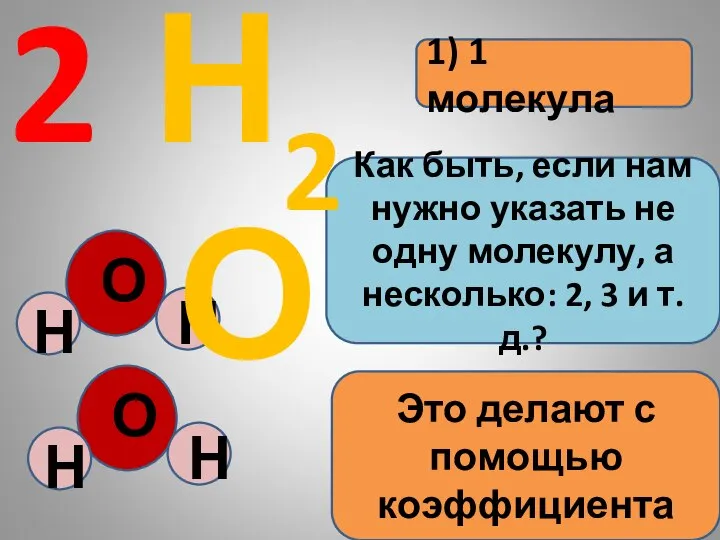
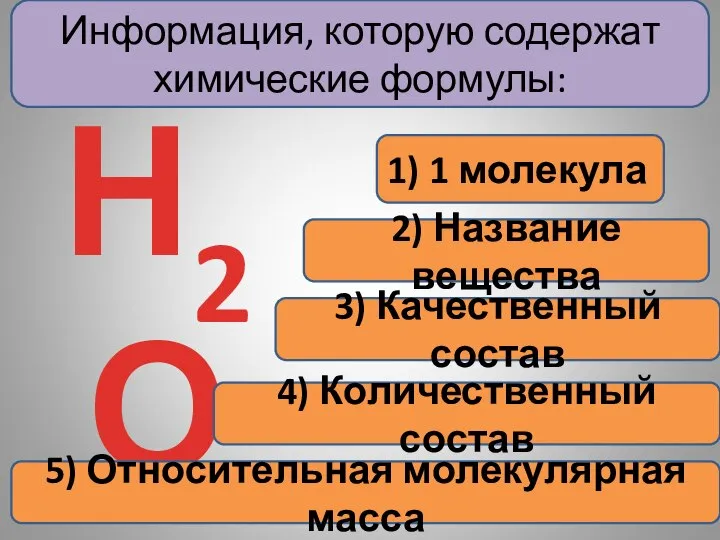
- 7. Информация, которую содержат химические формулы: 1) 1 молекула Н2О
- 8. 1) 1 молекула 2 Как быть, если нам нужно указать не одну молекулу, а несколько: 2,
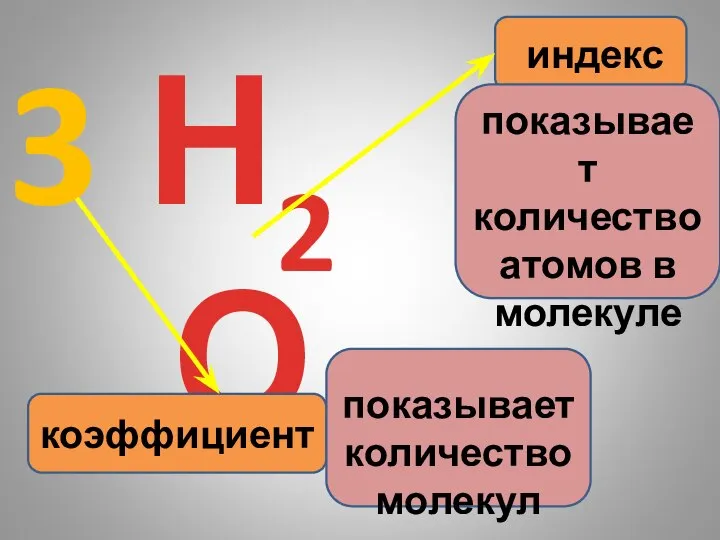
- 9. Н2О коэффициент индекс показывает количество атомов в молекуле 3 показывает количество молекул
- 10. II. Чтение химических формул. * Примеры: NH3 – молекула эн аш три состоит из одного атома
- 11. 1. В записи 5SO3 коэффициент равен: б) 15; в) 3; г) коэффициент отсутствует. 2. В записи
- 12. 3. В записи СO2коэффициент равен: б) 3; в) 2; г) коэффициент отсутствует. а) 1; 3. В
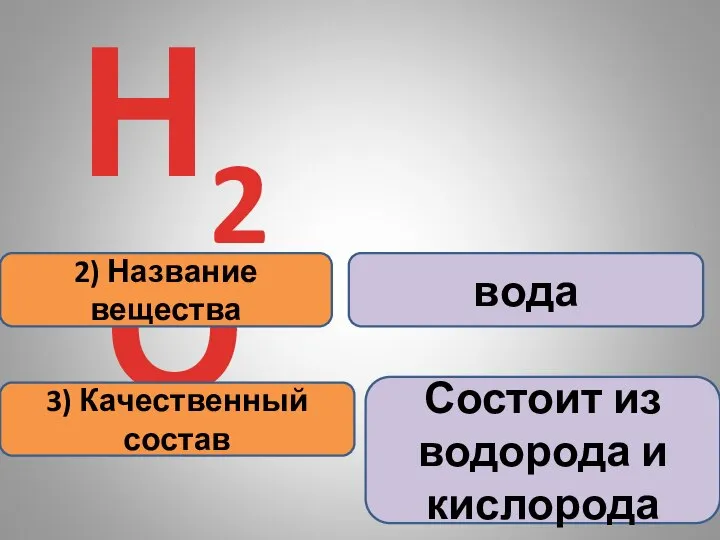
- 13. Информация, которую содержат химические формулы: 1) 1 молекула Н2О 2) Название вещества 3) Качественный состав
- 14. Н2О 2) Название вещества 3) Качественный состав вода Состоит из водорода и кислорода
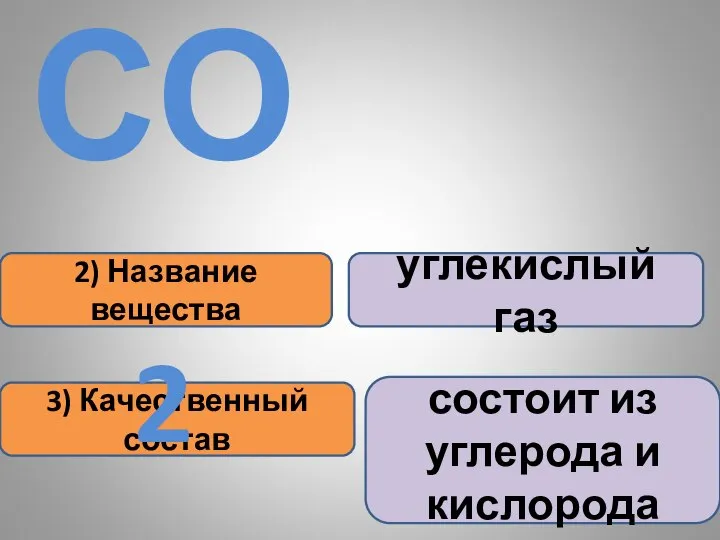
- 15. 2) Название вещества 3) Качественный состав углекислый газ состоит из углерода и кислорода СО2
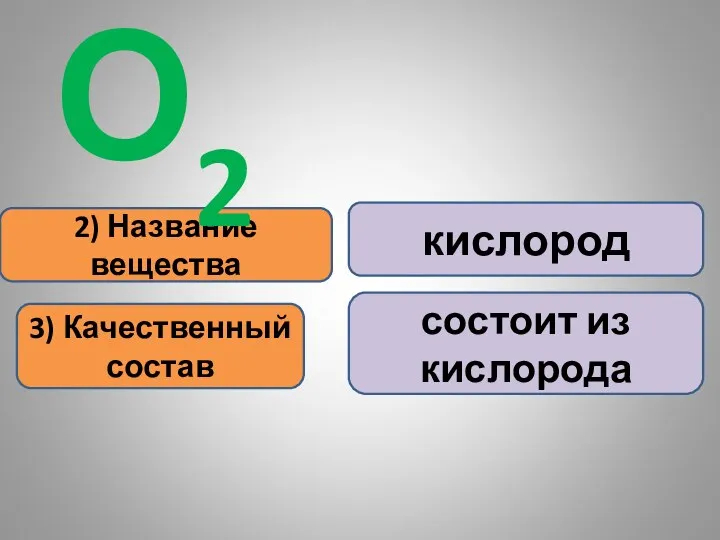
- 16. 2) Название вещества 3) Качественный состав кислород состоит из кислорода О2
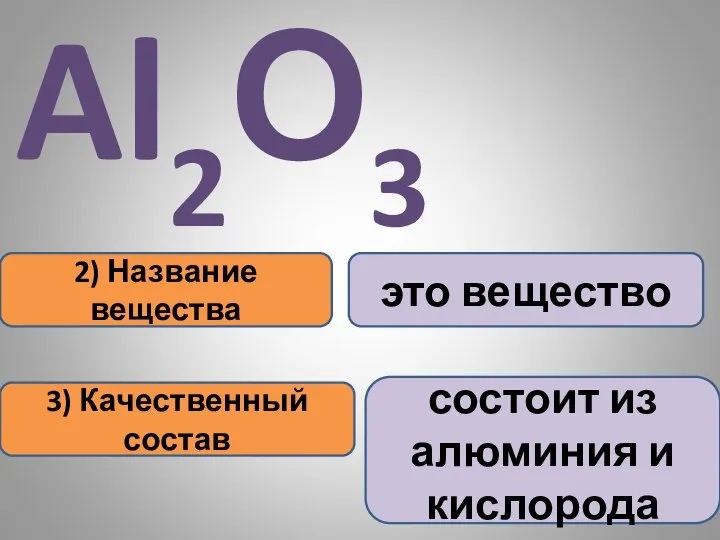
- 17. 2) Название вещества 3) Качественный состав это вещество состоит из алюминия и кислорода Al2О3
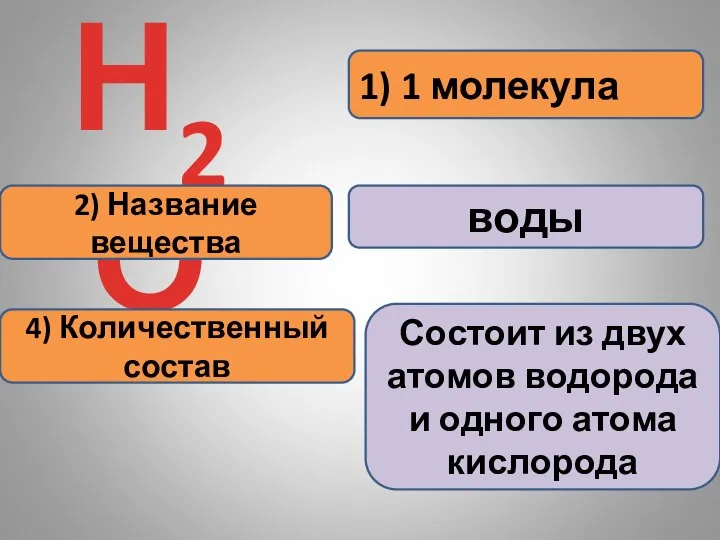
- 18. Информация, которую содержат химические формулы: 1) 1 молекула Н2О 2) Название вещества 3) Качественный состав 4)
- 19. 1) 1 молекула Н2О 2) Название вещества воды 4) Количественный состав Состоит из двух атомов водорода
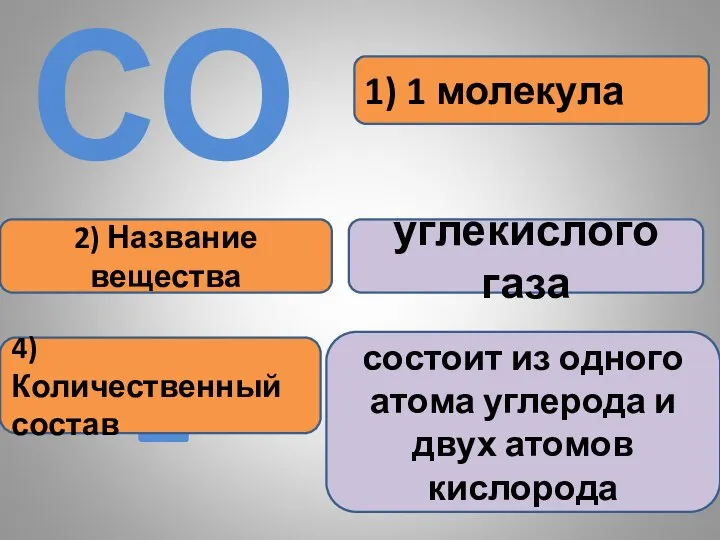
- 20. 1) 1 молекула 2) Название вещества углекислого газа СО2 4) Количественный состав состоит из одного атома
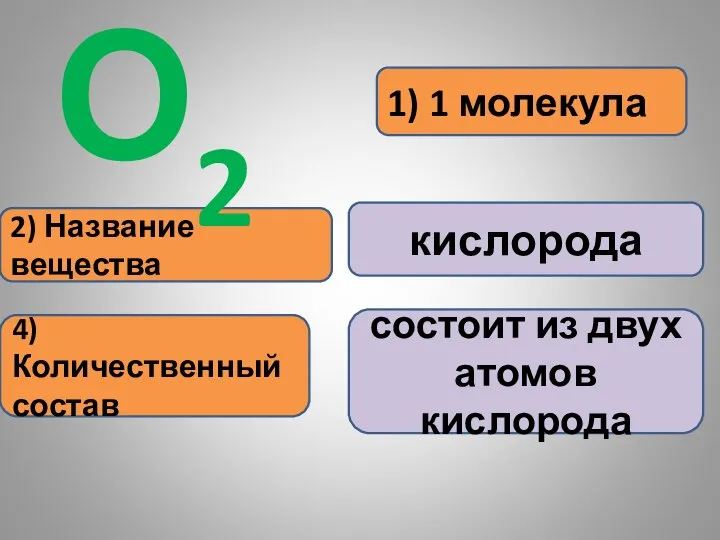
- 21. 1) 1 молекула 2) Название вещества кислорода О2 4) Количественный состав состоит из двух атомов кислорода
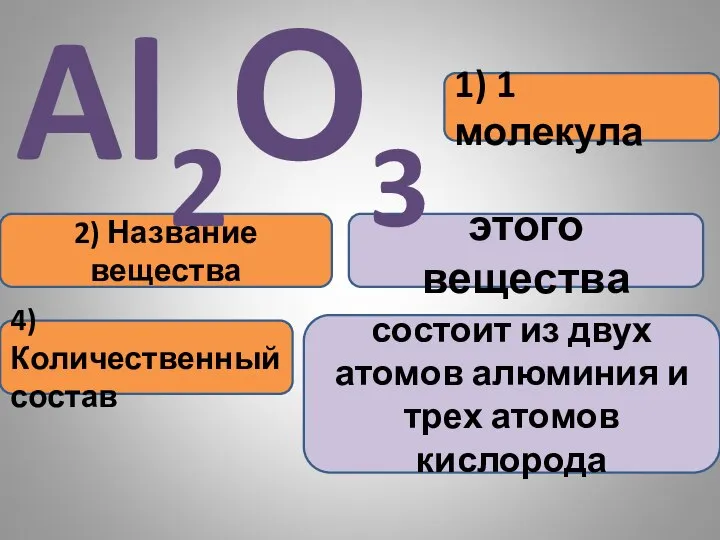
- 22. 1) 1 молекула 2) Название вещества этого вещества Al2О3 4) Количественный состав состоит из двух атомов
- 23. 7Н2SO4 Сколько молекул серной кислоты записано? Сколько атомов водорода записано? Сколько атомов серы записано? Сколько атомов
- 24. Когда мы знакомились с элементами, то узнали, что для измерения масс атомов ввели новую физическую величину.
- 25. Зная массы атомов, по химической формуле можно найти массу молекулы, которую назвали Мr - То есть
- 26. Информация, которую содержат химические формулы: 1) 1 молекула Н2О 2) Название вещества 3) Качественный состав 4)
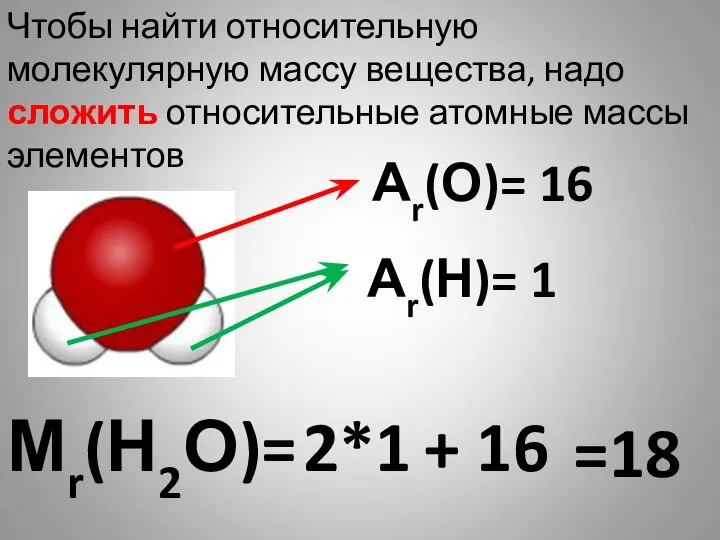
- 27. Мr(Н2О)= Чтобы найти относительную молекулярную массу вещества, надо сложить относительные атомные массы элементов Аr(О)= 16 Аr(Н)=
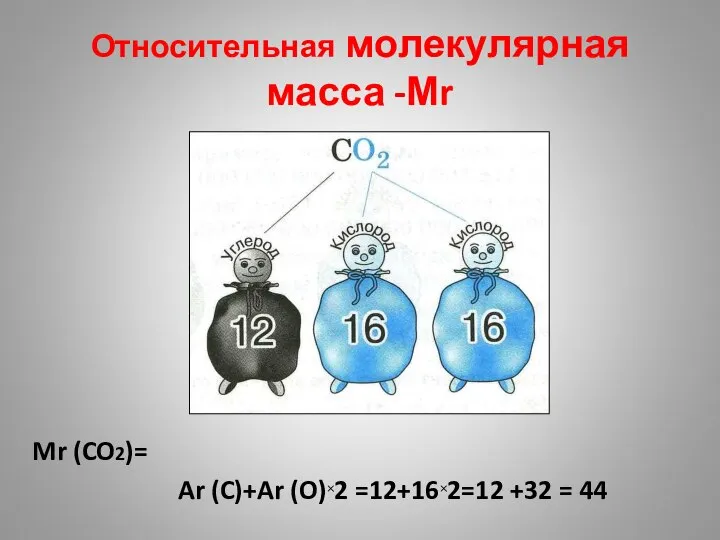
- 28. Относительная молекулярная масса -Мr Mr (CO2)= Ar (C)+Ar (O)×2 =12+16×2=12 +32 = 44
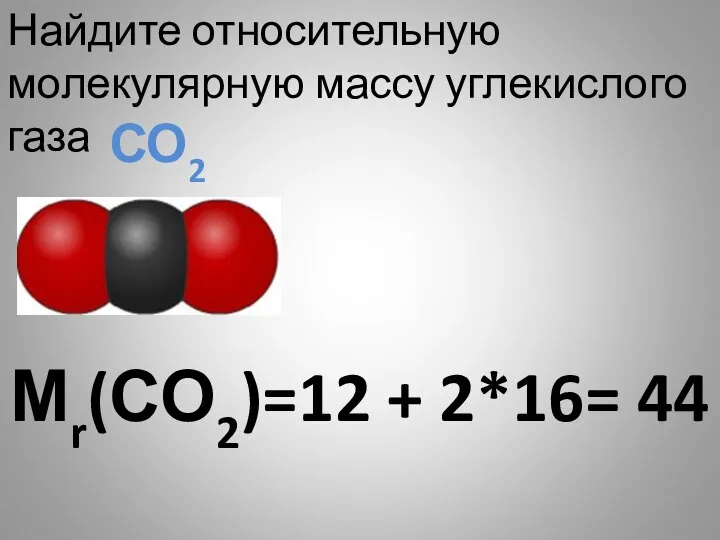
- 29. Мr(СО2)=12 + 2*16= 44 Найдите относительную молекулярную массу углекислого газа СО2
- 30. Найдите относительные молекуляр-ные массы следующих веществ: 1) кислорода О2 2) аммиака NH3 3) Оксида алюминия Аl2О3
- 31. Рассчитайте Мr (H2) = Mr (СаСl2) = Mr (CaCO3) = Мr (Ca(OH)2)= Mr (СН3СООН)= Мr (Ca3(PO4)2)=
- 32. САМОСТОЯТЕЛЬНАЯ РАБОТА 98 98 80 40 80 80 17 34
- 34. Скачать презентацию















 Валентность
Валентность Химия в быту
Химия в быту Типы химических реакций в органической химии
Типы химических реакций в органической химии Работа ученика 9 «в» класса МОУ «СОШ №59» Попова Михаила Руководитель Самсонова Г.М.
Работа ученика 9 «в» класса МОУ «СОШ №59» Попова Михаила Руководитель Самсонова Г.М. Презентация на тему Фосфорная кислота и ее свойства
Презентация на тему Фосфорная кислота и ее свойства  Энергетика химических реакций
Энергетика химических реакций Аномальные свойства воды
Аномальные свойства воды Химическая кинетика и равновесие
Химическая кинетика и равновесие Пластик: польза или вред
Пластик: польза или вред Презентация на тему Теория электролитической диссоциации.
Презентация на тему Теория электролитической диссоциации.  Строение атома
Строение атома Ферментативные методы анализа
Ферментативные методы анализа Водород. Доклад по химии
Водород. Доклад по химии СТЕПЕНЬ ОКИСЛЕНИЯ
СТЕПЕНЬ ОКИСЛЕНИЯ Металлы побочных подгрупп
Металлы побочных подгрупп Анодное растворение mn5si3-электрода в сернокислом фторидсодержащем электролите
Анодное растворение mn5si3-электрода в сернокислом фторидсодержащем электролите Ионная химическая связь
Ионная химическая связь Презентация на тему Руды металлов
Презентация на тему Руды металлов  Презентация по Химии "Химия в сельском хозяйстве"
Презентация по Химии "Химия в сельском хозяйстве"  Анализ свойств карбамидоформальдегидных смол
Анализ свойств карбамидоформальдегидных смол Общая характеристика нефти и газа
Общая характеристика нефти и газа Алканы – строение, химические свойства
Алканы – строение, химические свойства Ионные уравнения реакций
Ионные уравнения реакций Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Фосфор. Аллотропия фосфора. Физические и химические свойства фосфора
Фосфор. Аллотропия фосфора. Физические и химические свойства фосфора Звездный час. Конкурс химиков
Звездный час. Конкурс химиков Химический калейдоскоп
Химический калейдоскоп Углеводороды
Углеводороды