Содержание
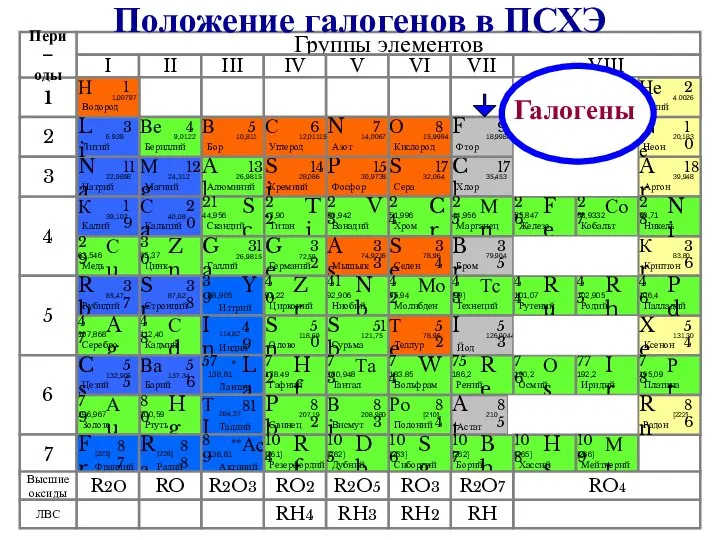
- 2. Галогены Положение галогенов в ПСХЭ
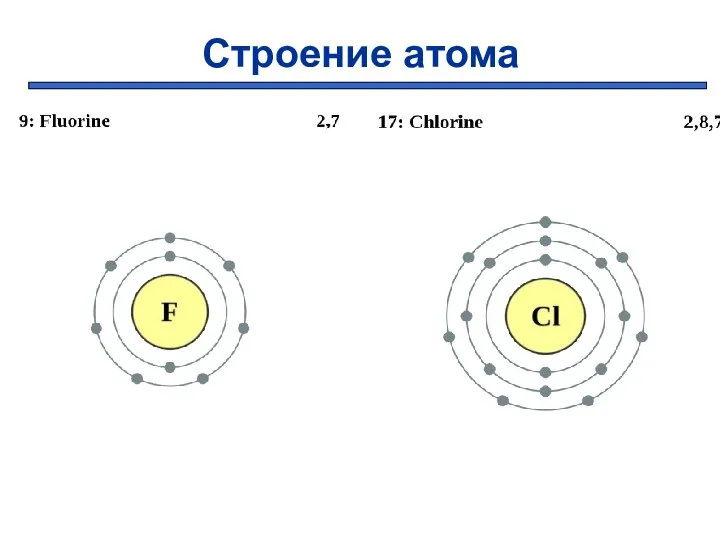
- 3. Строение атома
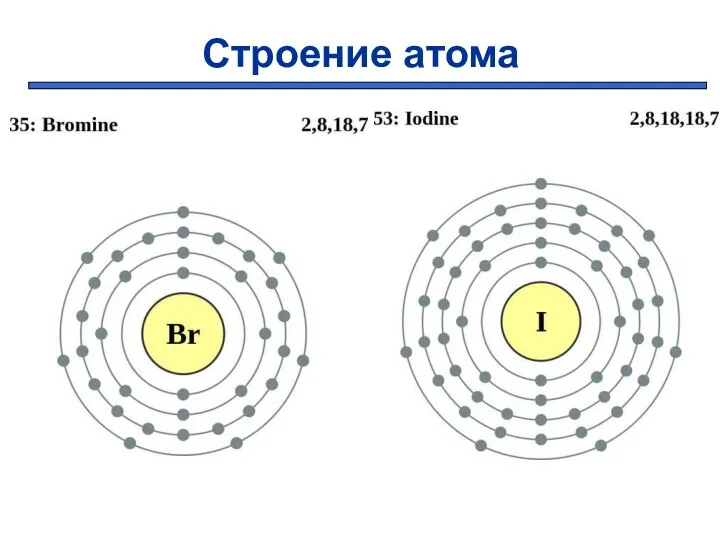
- 4. Строение атома
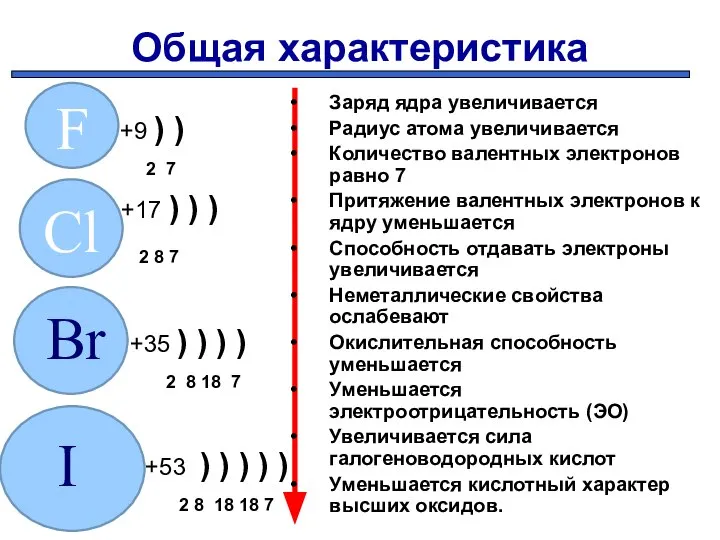
- 5. Общая характеристика +9 ) ) 2 7 +17 ) ) ) 2 8 7 +35 )
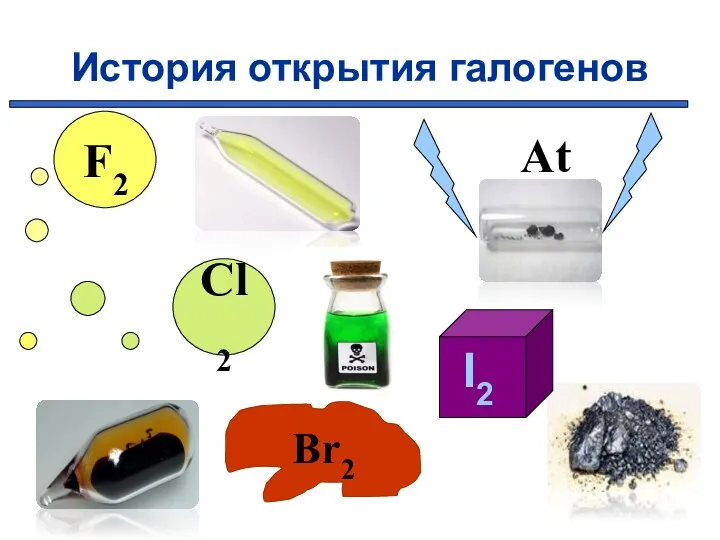
- 6. История открытия галогенов Cl2 At
- 7. В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в
- 8. В 1774 году шведский аптекарь К. Шееле открыл хлор. «Я поместил смесь черной магнезии с муриевой
- 9. В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал
- 10. В 1811 году французский химик Бернар Куртуа открыл йод путём перегонки маточных растворов от азотнокислого кальция
- 11. В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). Впервые астат
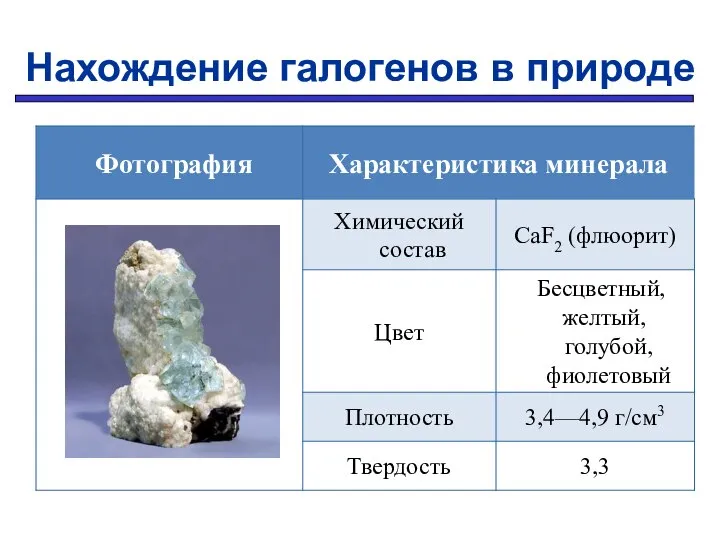
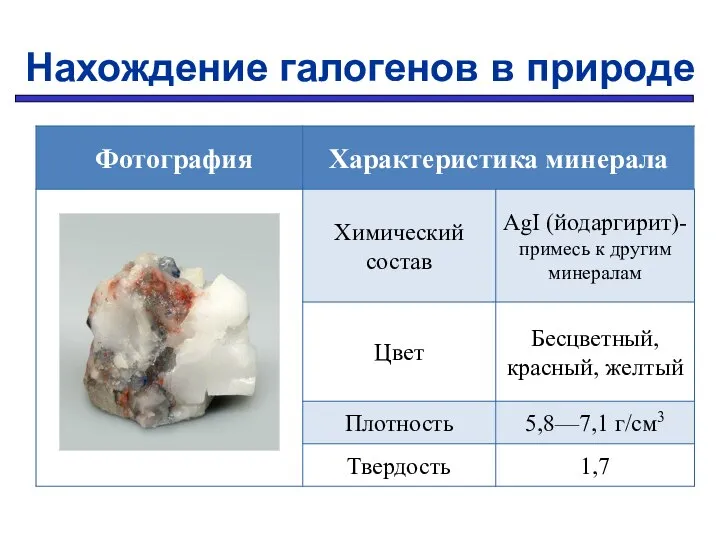
- 12. Нахождение галогенов в природе
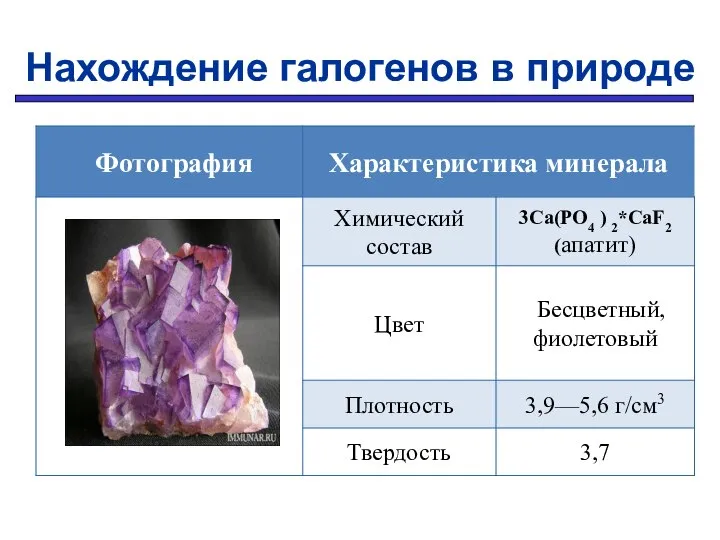
- 13. Нахождение галогенов в природе
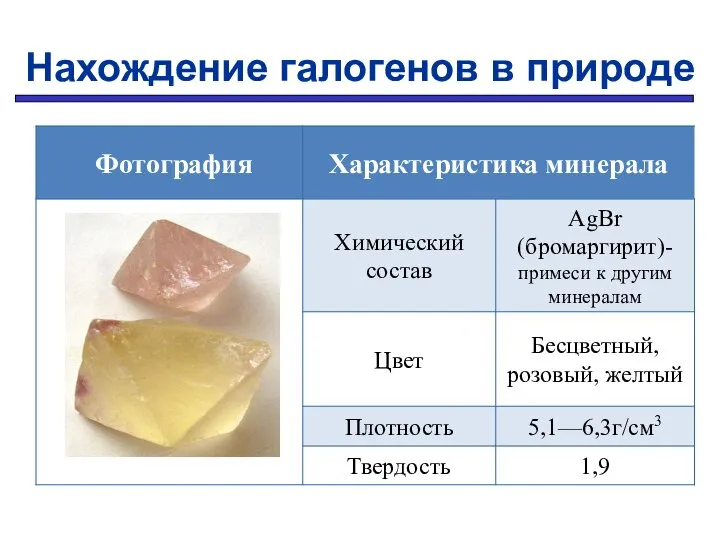
- 14. Нахождение галогенов в природе
- 15. Нахождение галогенов в природе
- 16. Нахождение галогенов в природе
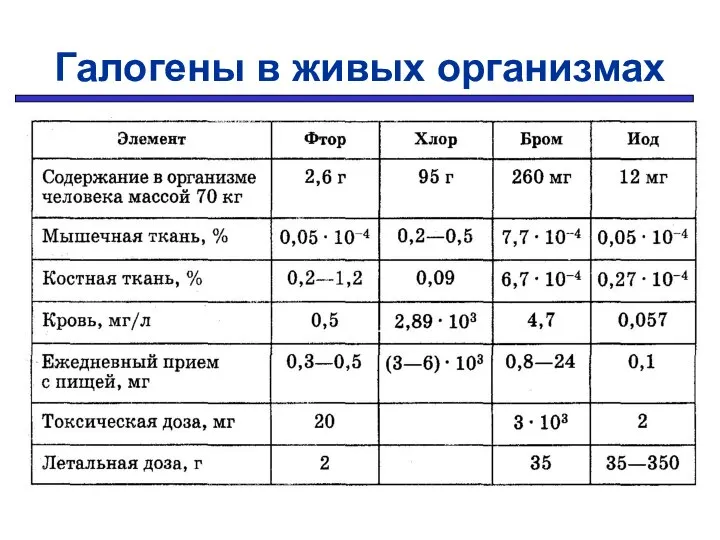
- 17. Галогены в живых организмах
- 18. ФТОР Группы элементов I III II VIII IV V VI VII II I III VII VI
- 19. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 20. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 21. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 22. Группы элементов I III II VIII IV V VI VII II I III VII VI V
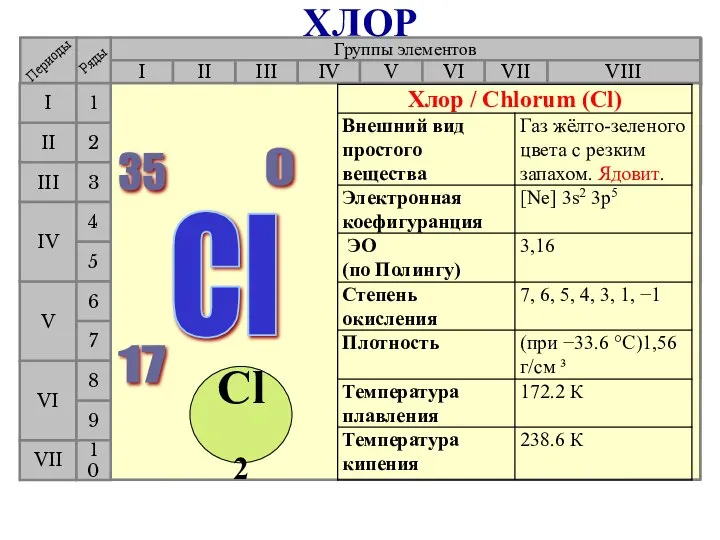
- 23. Галогены
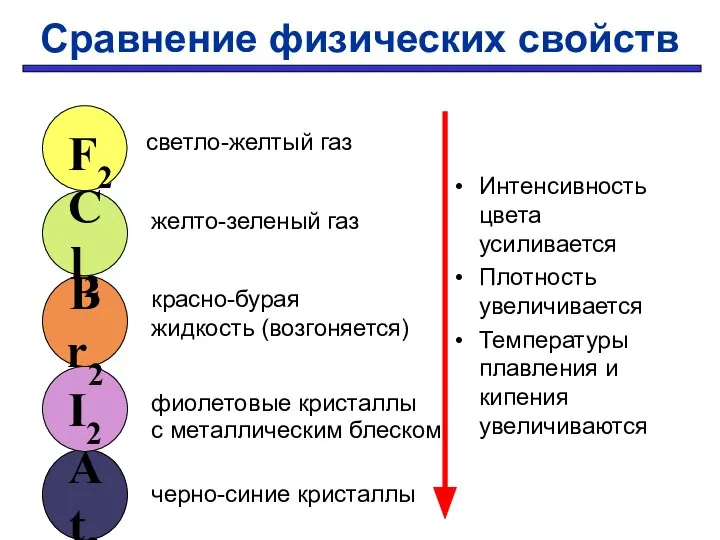
- 24. Сравнение физических свойств Интенсивность цвета усиливается Плотность увеличивается Температуры плавления и кипения увеличиваются At2 I2 Br2
- 25. Возгонка йода Кристаллический йод обладает способностью при нагревании переходить из твердого состояния в газообразное, минуя жидкое
- 26. Хлор хвалился: «Нет мне равных! Галоген я - самый главный. Зря болтать я не люблю: Всё
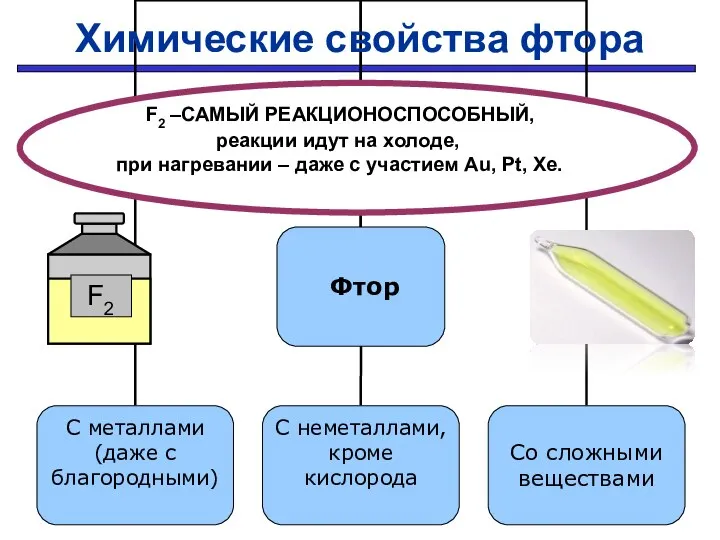
- 27. Проверить F2 –САМЫЙ РЕАКЦИОНОСПОСОБНЫЙ, реакции идут на холоде, при нагревании – даже с участием Au, Pt,
- 28. С простыми веществами: С МЕталлами С Неметаллами 2Na + F2 → 2NaF H2 + F2 →
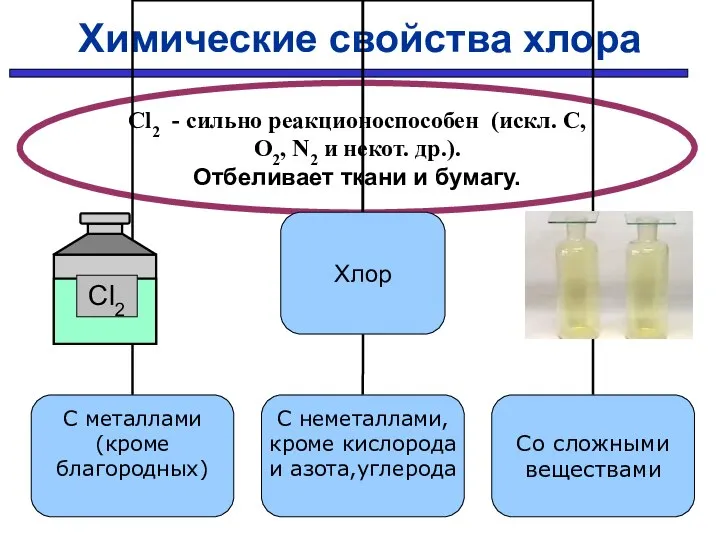
- 29. Химические свойства хлора Cl2 - сильно реакционоспособен (искл. C, O2, N2 и некот. др.). Отбеливает ткани
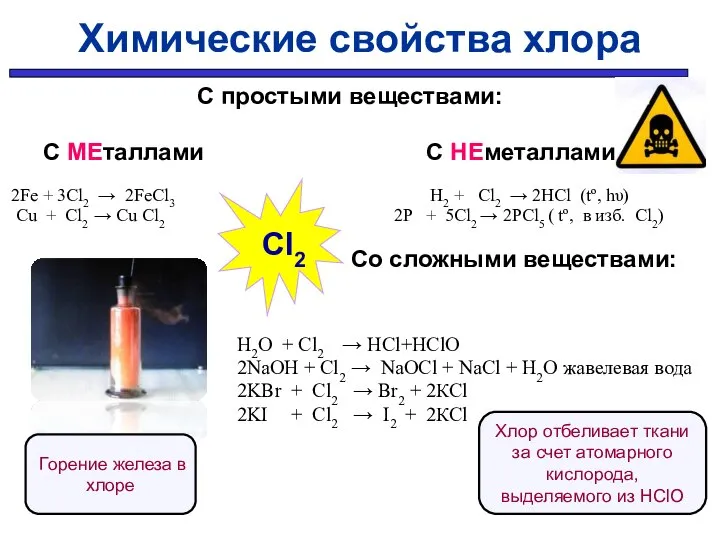
- 30. С простыми веществами: С МЕталлами С НЕметаллами 2Fe + 3Cl2 → 2FeCl3 H2 + Cl2 →
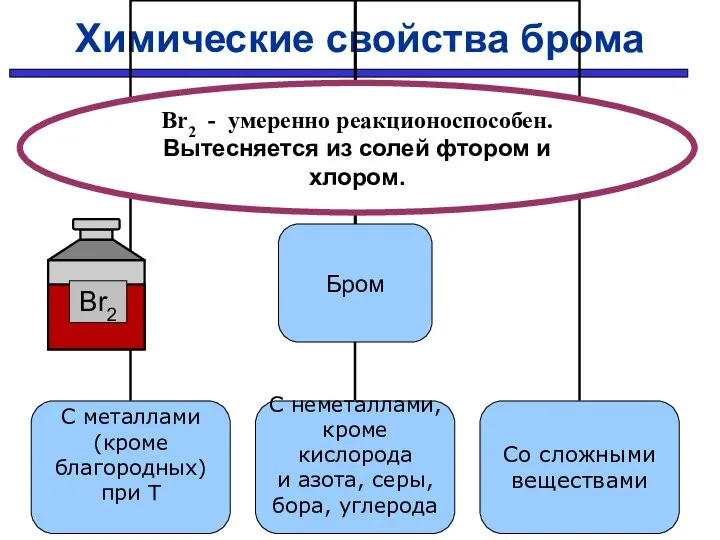
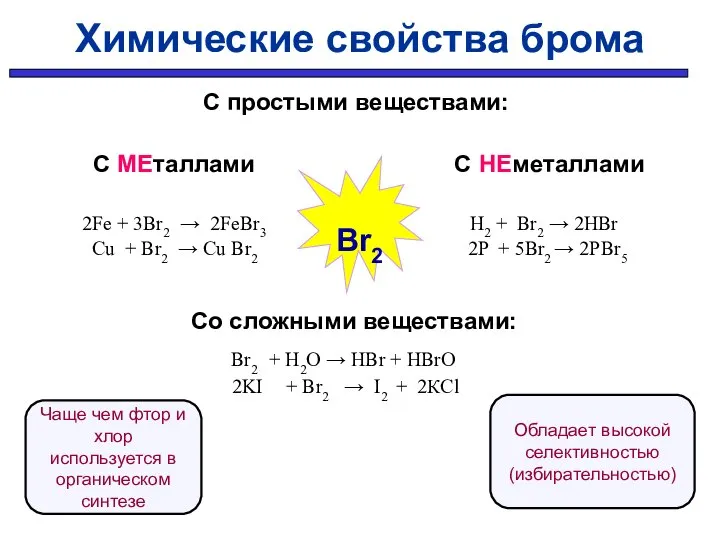
- 31. Химические свойства брома Br2 - умеренно реакционоспособен. Вытесняется из солей фтором и хлором.
- 32. С простыми веществами: С МЕталлами С НЕметаллами 2Fe + 3Br2 → 2FeBr3 H2 + Br2 →
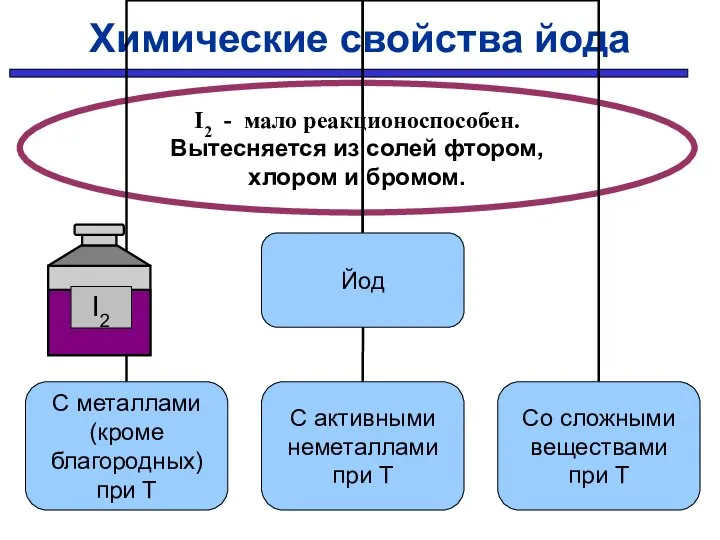
- 33. Химические свойства йода I2 - мало реакционоспособен. Вытесняется из солей фтором, хлором и бромом.
- 34. С простыми веществами: С металлами С неметаллами Hg + I2 → HgI2 H2 + I2 →
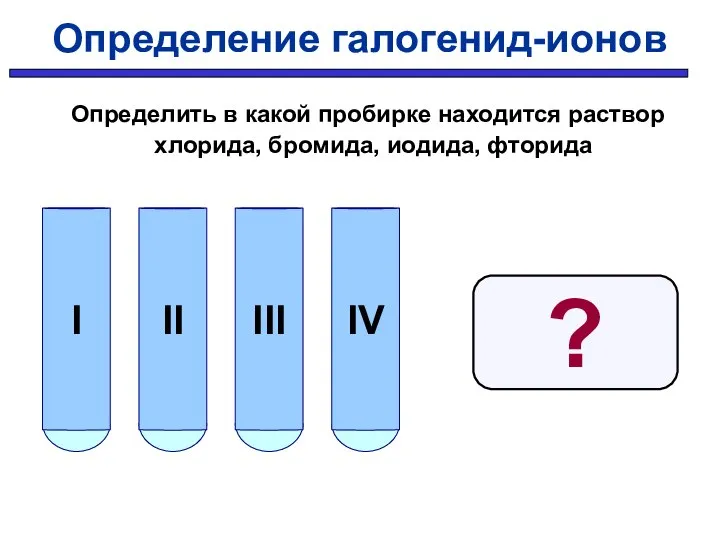
- 35. Определение галогенид-ионов Определить в какой пробирке находится раствор хлорида, бромида, иодида, фторида ?
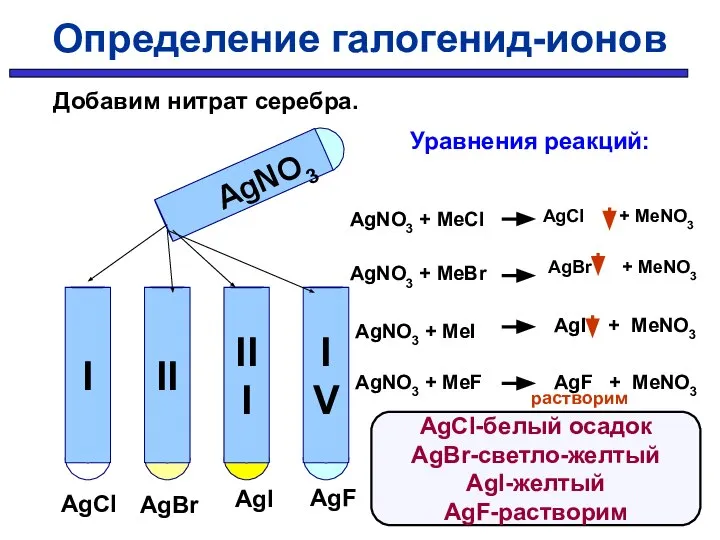
- 36. AgNO3 AgCl AgBr AgI AgF Уравнения реакций: AgNO3 + MeCl AgNO3 + MeBr AgNO3 + MeI
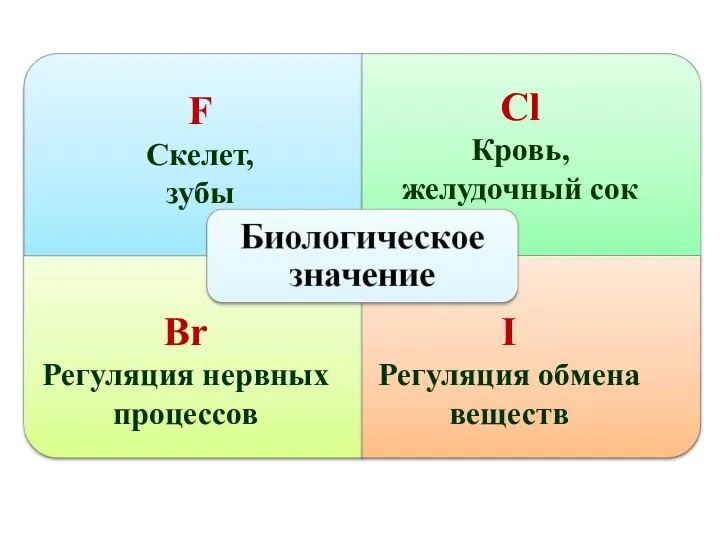
- 37. F Скелет, зубы Сl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена веществ
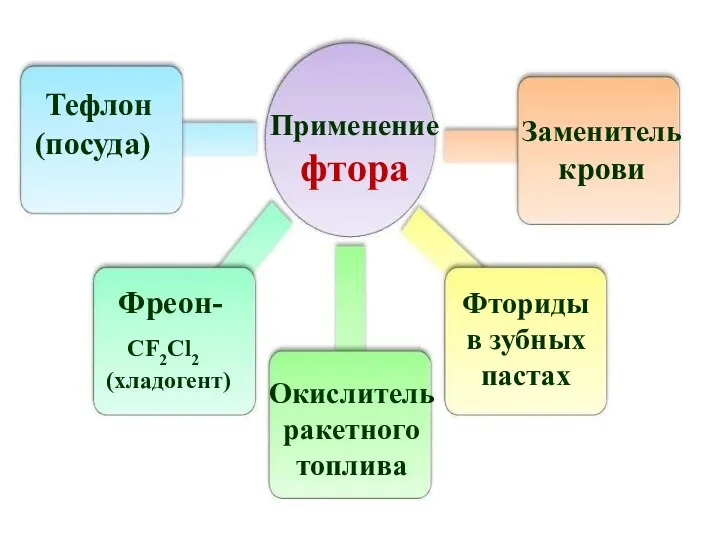
- 38. Применение фтора Тефлон (посуда) Фреон- CF2Cl2 (хладогент) Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
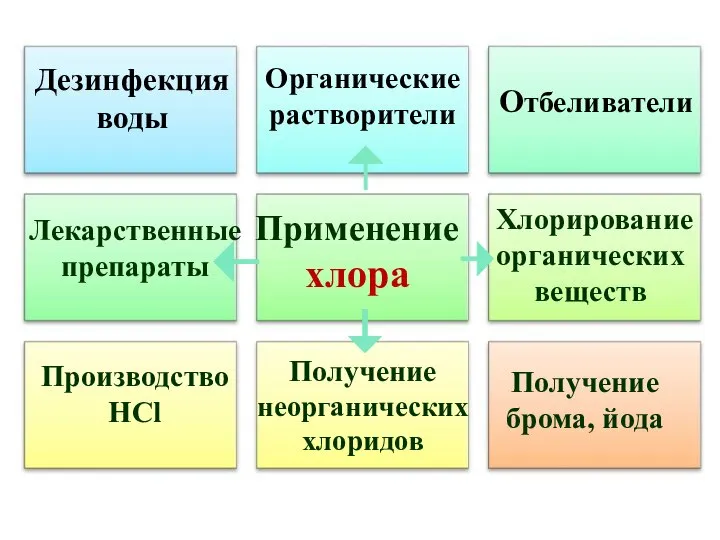
- 39. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
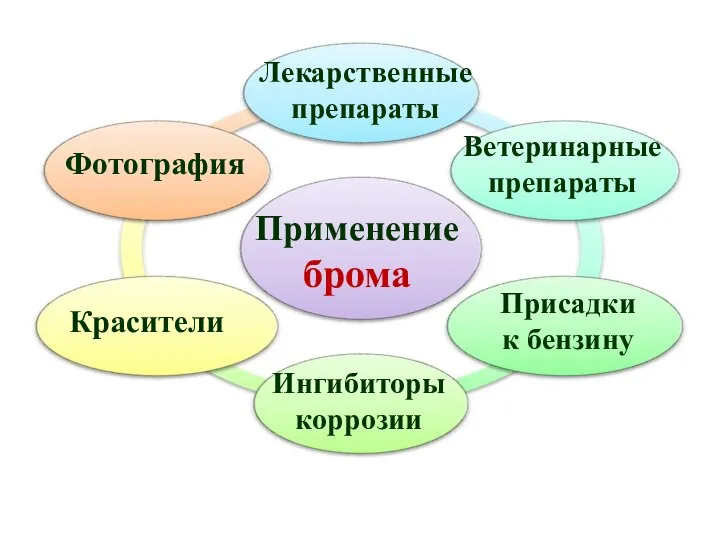
- 40. Применение брома Лекарственные препараты Красители Фотография Ветеринарные препараты Ингибиторы коррозии Присадки к бензину
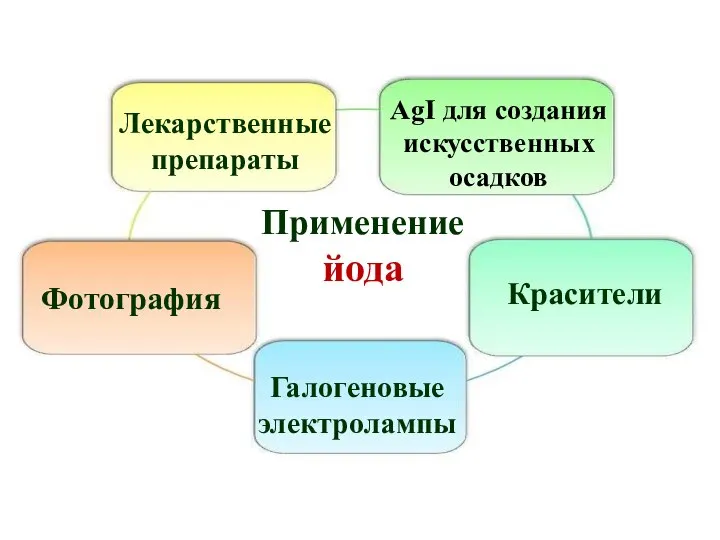
- 41. Применение йода Лекарственные препараты Фотография Красители AgI для создания искусственных осадков Галогеновые электролампы
- 42. Спасибо за внимание !
- 44. Скачать презентацию
















 Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература Высшие жирные кислоты липиды биомембраны. Лекция 3
Высшие жирные кислоты липиды биомембраны. Лекция 3 Презентация на тему Аммиак
Презентация на тему Аммиак  Органическая химия
Органическая химия 8_ANIONY_2_3_angr
8_ANIONY_2_3_angr Электролиз и его применение
Электролиз и его применение Презентация на тему Моющие средства
Презентация на тему Моющие средства 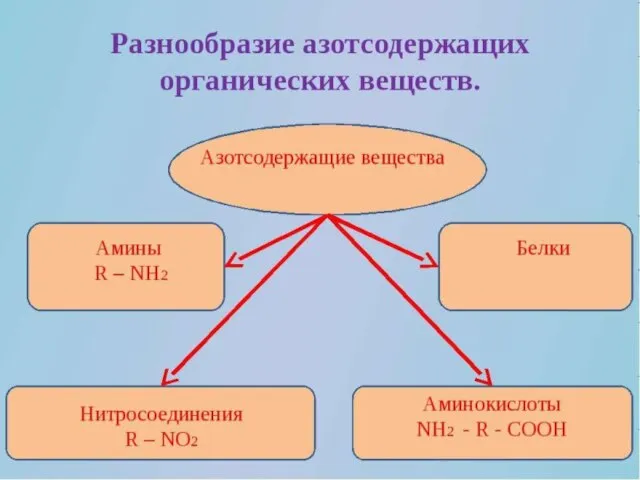 Разнообразие азотсодержащих органических веществ
Разнообразие азотсодержащих органических веществ Калийные удобрения
Калийные удобрения Разветвленные цепные реакции
Разветвленные цепные реакции Основания и их свойства
Основания и их свойства Валентность
Валентность Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Закон сохранения массы веществ. Типы химических реакций
Закон сохранения массы веществ. Типы химических реакций Водородная химическая связь
Водородная химическая связь Фестиваль песчаных скульптур
Фестиваль песчаных скульптур lektsia_7
lektsia_7 Презентация на тему Коррозия металлов
Презентация на тему Коррозия металлов  Строение атома Степень окисления. Валентность. Ионы
Строение атома Степень окисления. Валентность. Ионы Презентация на тему Использование информационных технологий на уроках химии
Презентация на тему Использование информационных технологий на уроках химии  Интересные свойства пластика
Интересные свойства пластика Русские ученые- химики
Русские ученые- химики Проведение лабраторных общеклинических исследований
Проведение лабраторных общеклинических исследований Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов
Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Молярный объем
Молярный объем Презентация по Химии "Соединения алюминия"
Презентация по Химии "Соединения алюминия"  Классы неорганических соединений (основания)
Классы неорганических соединений (основания)