Содержание
- 2. обобщить знания об алюминии и его соединениях, опытным путем изучить амфотерность оксида и гидроксида алюминия, уметь
- 3. Вопросы для беседы: Положение алюминия в ПСХЭ. Какими химическими свойствами обладает алюминий – простое вещество? Что
- 4. «Люди гибнут за металл» В.Гете. 1. Подумайте, почему алюминий так дорого ценился? 2. Какие соединения образует
- 5. Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия. В обе пробирки
- 6. Доказательство амфотерности: Опыт1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. Опыт 2.Взаимодействие
- 7. Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя
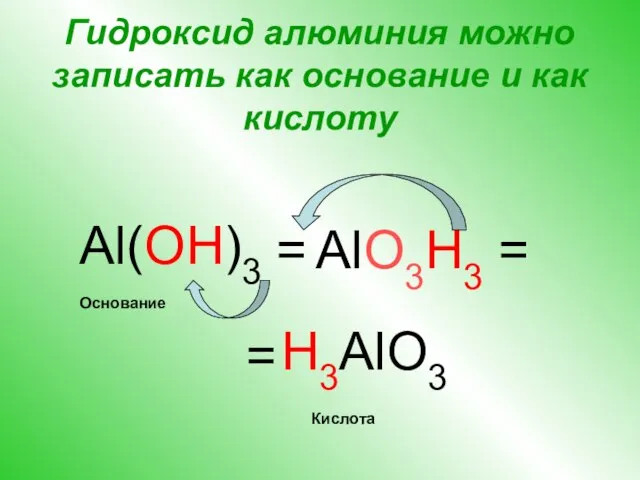
- 8. Гидроксид алюминия можно записать как основание и как кислоту Al(OH)3 = H3AlO3 AlO3H3 = = Кислота
- 9. Al(OH)3 + 3HCl = AlCl3 +3H2O H3AlO3 + 3NaOH = Na3AlO3+3H2O Хлорид алюминия Алюминат натрия Запишите
- 10. Al2O3 + 6HCl = 2AlCl3 + 3H2O Al2O3 + 3NaOH = Na3AlO3 + 3H2O Как основный
- 11. Алюминий в природе 1.Боксит 2.Рубин 3.Каолин
- 12. Применение соединений алюминия
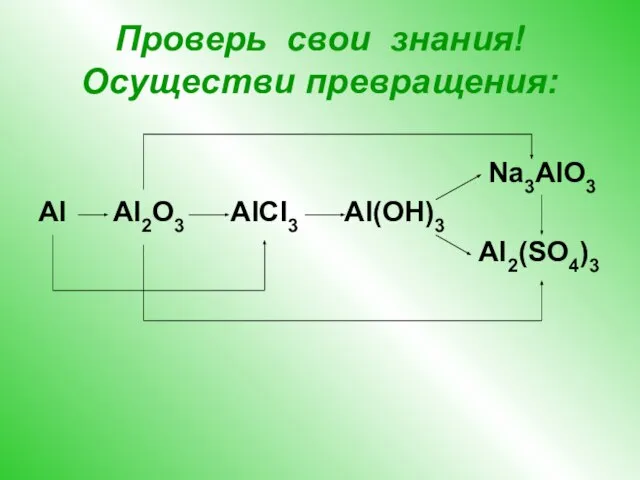
- 13. Проверь свои знания! Осуществи превращения: Na3AlO3 Al Al2O3 AlCl3 Al(OH)3 Al2(SO4)3
- 15. Скачать презентацию










 Свойства глюкозы
Свойства глюкозы Ферсман Александр Евгеньевич Очарованный камнем
Ферсман Александр Евгеньевич Очарованный камнем Цветные опыты
Цветные опыты Презентация на тему В мире индикаторов - исследовательская работа
Презентация на тему В мире индикаторов - исследовательская работа  Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Комплексные соединения
Комплексные соединения Подготовка к контрольной работе. 8 класс
Подготовка к контрольной работе. 8 класс Приходченко ФЕР-2031
Приходченко ФЕР-2031 Презентация на тему Хлор - физиологическая и патологическая роль в организме человека
Презентация на тему Хлор - физиологическая и патологическая роль в организме человека  Презентация на тему Ионные уравнения
Презентация на тему Ионные уравнения  Вода - растворитель
Вода - растворитель Щелочноземельные металлы
Щелочноземельные металлы Строение атома
Строение атома Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Алкины. Способы получения
Алкины. Способы получения Астат. Свойства астата
Астат. Свойства астата Расчет энтропии образования и теплоемкости органических веществ методом Бенсона
Расчет энтропии образования и теплоемкости органических веществ методом Бенсона Дизельное топливо
Дизельное топливо Для чего нужна нефть
Для чего нужна нефть Решение расчетных задач по уравнениям реакций
Решение расчетных задач по уравнениям реакций Общие свойства металлов
Общие свойства металлов Непредельные углеводороды
Непредельные углеводороды Строение и свойства металлов. Материаловедение. Лекция 1
Строение и свойства металлов. Материаловедение. Лекция 1 Органическая химия. Теория строения органических соединений
Органическая химия. Теория строения органических соединений Облик и габитус кристаллов
Облик и габитус кристаллов Применение неорганических соединений в пищевой промышленности
Применение неорганических соединений в пищевой промышленности Nevarne snovi
Nevarne snovi Презентация на тему Химический "Звездный час"
Презентация на тему Химический "Звездный час"