Содержание
- 2. Проверка. Ответы: 1 вариант HCl 2HCl + BaCO3 = BaCl2 + CO2+ H2O 2H+ +2Cl- +
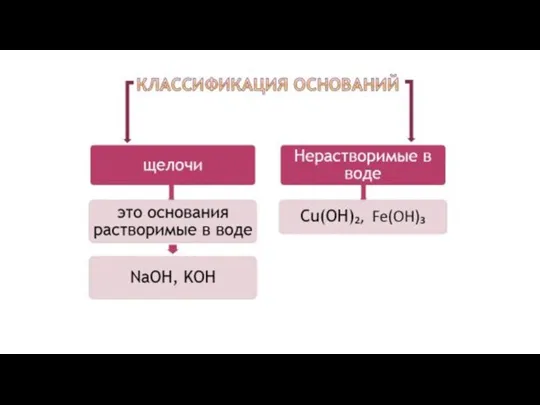
- 3. Основания (гидроксиды) Основания – электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы ОН-
- 4. Номенклатура оснований (правила составления химических названий) Пример: NaOH – гидроксид (чего?) натрия Fe2+ (OH)2 – гидроксид
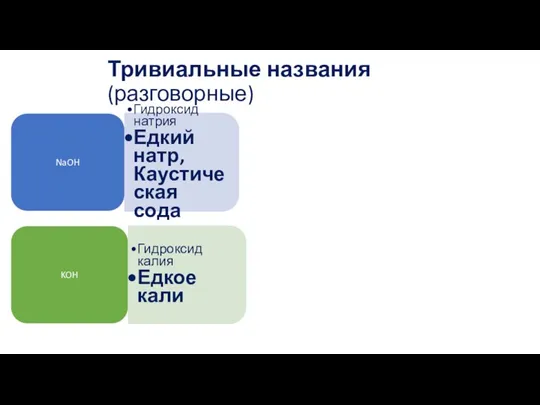
- 5. Тривиальные названия (разговорные) NaOH Гидроксид натрия Едкий натр, Каустическая сода KOH Гидроксид калия Едкое кали
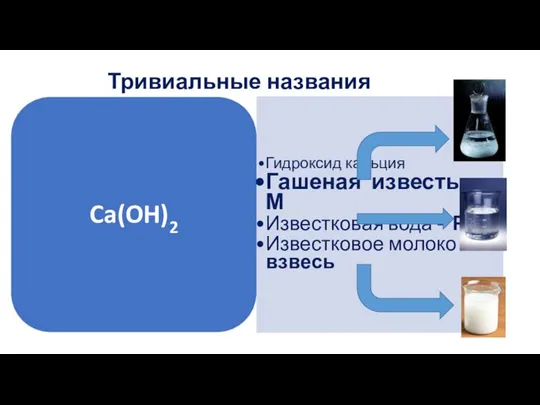
- 6. Тривиальные названия Ca(OH)2 Гидроксид кальция Гашеная известь – М Известковая вода – Р Известковое молоко -
- 8. Выполнить задания Карточка 2
- 9. Ответы Карточка 2 Распознать основания: 1. CH3OH 2. CrPO4 3. H2SiO3 4. CsOH
- 10. Ответы 2. Составить формулы оснований, образованных следующими металлами, назвать их: К - KOH Al - Al(OH)3
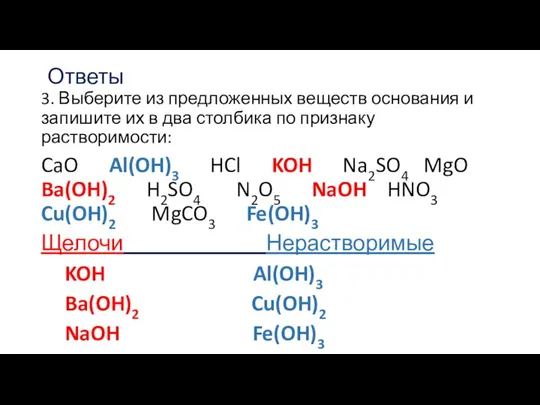
- 11. Ответы 3. Выберите из предложенных веществ основания и запишите их в два столбика по признаку растворимости:
- 12. ОБЖ щелочи Разъедают кожу и слизистые ткани Все работы проводить в очках и резиновых перчатках При
- 13. Химические свойства оснований. 1 задание: Прилить к р-ру КOH + р-р фенолфталеина 1) свойство: 2 задание:
- 14. Запись в тетради: 1 свойство: изменяет окраску индикатора KOH + фенолфталеин = малиновый цвет раствора Почему?
- 15. 2. Написать уравнение реакции Cu(OH)2 + HNO3→ В чем суть реакции? Какие ионы «встретились»?
- 16. 3. Написать уравнение реакции NaOH + Zn(NO3)2 → В чем суть реакции? Какие ионы «встретились»?
- 17. Кислотные оксиды – им соответствуют кислоты N2O5 СO2
- 18. 4) свойство: Щелочь + Кислотный оксид = Соль + Вода (оксид неметалла) - это реакция обмена
- 19. Сначала под формулой кислотного оксида пишем формулу соответствующей кислоты. NaOH + N2O5 = (HNO3) азотная кислота
- 20. Cu(OH)2 = CuO + H2O 5) свойство: нерастворимые основания разлагаются при нагревании
- 21. Какие ионы определяют свойства растворов оснований?
- 22. 5. Написать уравнение реакций разложения Fe(OH)3 = Zn(OH)2 =
- 23. Получение оснований просмотр: mmlab.chemistry.527.oms
- 25. Скачать презентацию


















 Химия ионных жидкостей
Химия ионных жидкостей Из опыта использования интерактивной доски на уроках химии
Из опыта использования интерактивной доски на уроках химии Закон эквивалентов
Закон эквивалентов Получение углекислого газа и изучение его свойств. Практическая работа
Получение углекислого газа и изучение его свойств. Практическая работа Дизайн молекулярных магнетиков
Дизайн молекулярных магнетиков Химия 11 класс
Химия 11 класс Презентация на тему Алюминий и его соединения
Презентация на тему Алюминий и его соединения  Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А.
Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А. Исследование методов синтеза 5-аминосалициловой кислоты
Исследование методов синтеза 5-аминосалициловой кислоты Общая характеристика МЕТАЛЛОВ
Общая характеристика МЕТАЛЛОВ Сода. Что я знаю о ней!?
Сода. Что я знаю о ней!? Химическая кинетика. Основные понятия. Основы формальной кинетики
Химическая кинетика. Основные понятия. Основы формальной кинетики Презентация на тему Алюминий(Al)
Презентация на тему Алюминий(Al)  Получение меди
Получение меди Сложные эфиры. Содержание. Определение
Сложные эфиры. Содержание. Определение Общие вопросы материаловедения
Общие вопросы материаловедения Блок-схема функциональных элементов клеточного метаболизма
Блок-схема функциональных элементов клеточного метаболизма Фенол. Физические свойства
Фенол. Физические свойства Оксиды азота
Оксиды азота Валентные состояния атома углерода
Валентные состояния атома углерода Циклоалканы. Номенклатура и строение
Циклоалканы. Номенклатура и строение Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах
Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах Презентация на тему Предельные углеводороды
Презентация на тему Предельные углеводороды  Организация физической защиты ДРМ
Организация физической защиты ДРМ Exotermické a endotermické reakcie
Exotermické a endotermické reakcie Химия и жизнь
Химия и жизнь Производство аммиака
Производство аммиака Хроматография. Особенности метода хроматографии
Хроматография. Особенности метода хроматографии