Слайд 2Коррозия, ржавление, — это самопроизвольное разрушение металлов и сплавов в результате химического, электрохимического или физико-химического

взаимодействия с окружающей средой. Разрушение по физическим причинам не является коррозией, а характеризуется понятиями «эрозия», «истирание», «износ». Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде.
Слайд 3Коррозия Металлов
Коррозия металлов — разрушение металлов вследствие химического или электрохимического взаимодействия их с

коррозионной средой. Для процесса коррозии следует применять термин «коррозионный процесс», а для результата процесса — «коррозионное». Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов, — коррозии. Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов.
Слайд 4Виды коррозии : Послойная коррозия
Нитевидная коррозия
Структурная коррозия
Межкристаллитная коррозия
Избирательная коррозия
Графитизация чугуна
Обесцинкование
Щелевая коррозия
Ножевая коррозия
Коррозионная

язва
Коррозионное растрескивание
Коррозия под напряжением
Коррозионная усталость
Предел коррозионной усталости
Коррозионная хрупкость
Слайд 5Электрохимическая коррозия
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют
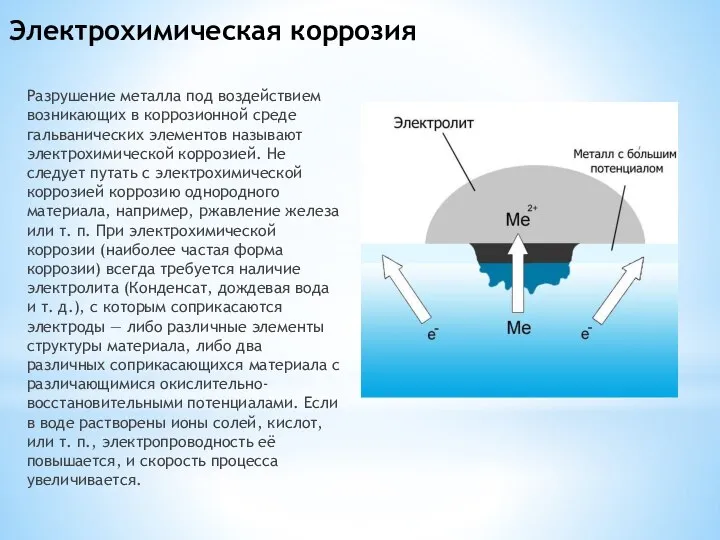
электрохимической коррозией. Не следует путать с электрохимической коррозией коррозию однородного материала, например, ржавление железа или т. п. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается.
Слайд 6Коррозия приводит ежегодно к миллиардным убыткам, и решение этой проблемы является важной

задачей. Основной ущерб, причиняемый коррозией, заключается не в потере металла как такового, а в огромной стоимости изделий, разрушаемых коррозией. Вот почему ежегодные потери от неё в промышленно развитых странах столь велики. Истинные убытки от неё нельзя определить, оценив только прямые потери, к которым относятся стоимость разрушившейся конструкции, стоимость замены оборудования, затраты на мероприятия по защите от коррозии. Ещё больший ущерб составляют косвенные потери. Это простои оборудования при замене прокорродировавших деталей и узлов, утечка продуктов, нарушение технологических процессов.





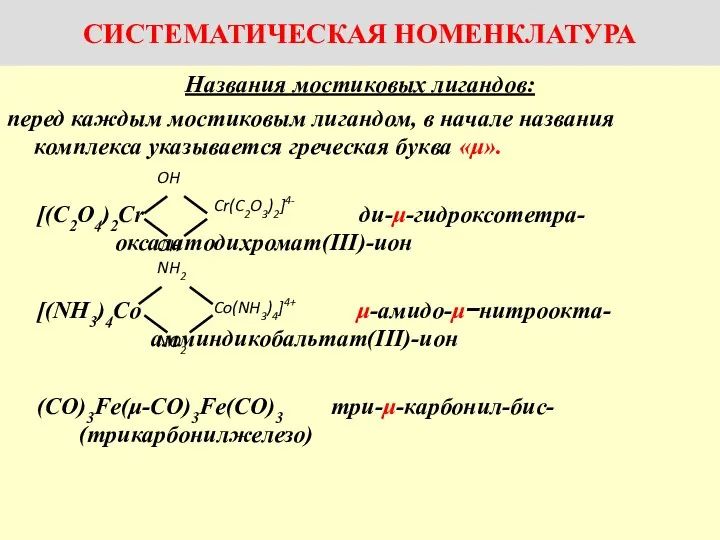 Названия комплексов с мостиковыми лигандами
Названия комплексов с мостиковыми лигандами Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов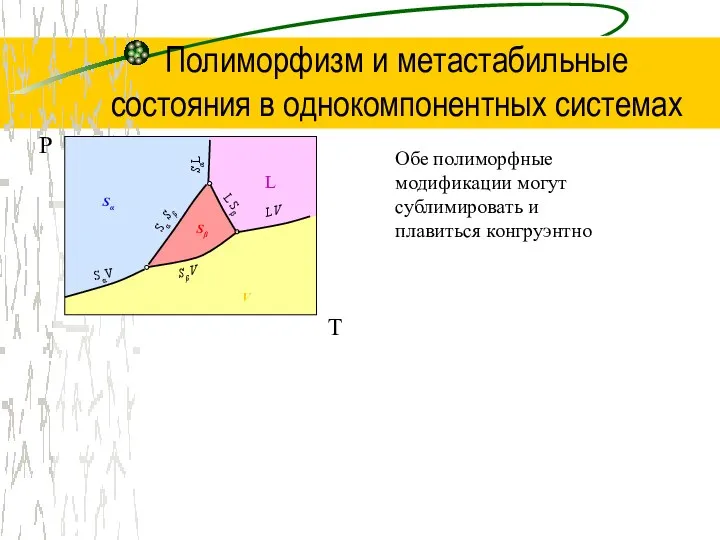 Полиморфизм и метастабильные состояния в однокомпонентных системах
Полиморфизм и метастабильные состояния в однокомпонентных системах Презентация на тему Викторина "Узнай химический элемент"
Презентация на тему Викторина "Узнай химический элемент"  Галогены
Галогены Углеводы, 2 часть. Лекция 15
Углеводы, 2 часть. Лекция 15 Азот. Нахождение в природе
Азот. Нахождение в природе Классификация веществ. Кислоты. Основания. Соли
Классификация веществ. Кислоты. Основания. Соли Алканы. Строение
Алканы. Строение Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай
Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Химия природная и синтетическая: за и против
Химия природная и синтетическая: за и против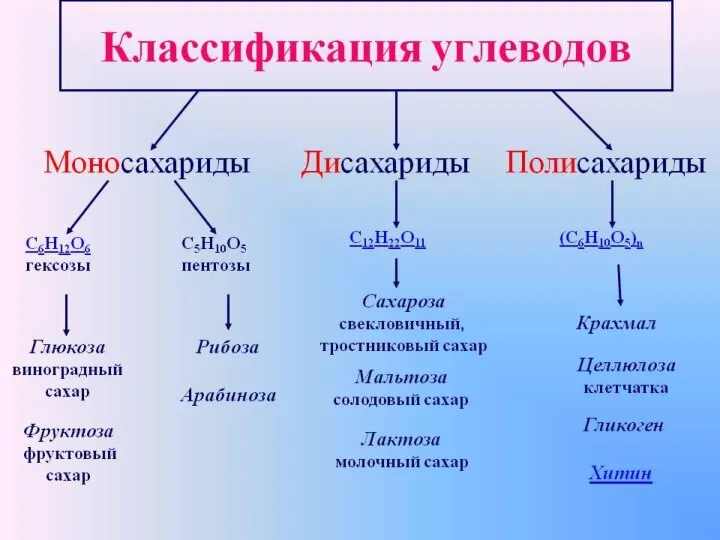 Классификация углеродов
Классификация углеродов Курсовой синтез ацетоуксусного эфира
Курсовой синтез ацетоуксусного эфира Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделева
Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделева Круговорот азота в природе
Круговорот азота в природе Арены. Бензол
Арены. Бензол Положение металлов в Периодической системе химических элементов Д.И.Менделеева
Положение металлов в Периодической системе химических элементов Д.И.Менделеева Стереоизомерия
Стереоизомерия Презентация на тему Аминокислоты. История их открытия
Презентация на тему Аминокислоты. История их открытия  Применение серы, хлора, углерода
Применение серы, хлора, углерода Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини Геометрия молекул
Геометрия молекул Синтез поликонденсационных полимеров
Синтез поликонденсационных полимеров Строение атома
Строение атома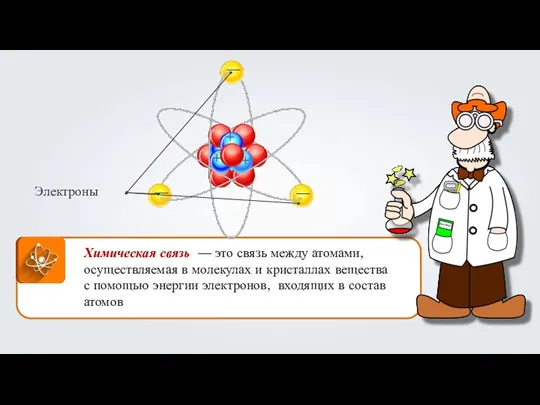 Ковалентная неполярная химическая связь
Ковалентная неполярная химическая связь Пищевые кислоты
Пищевые кислоты