Содержание
- 2. Общая характеристика Галогены (от греч. «рождающие соли») главная подгруппа 7 группы: F, Cl, Br, I и
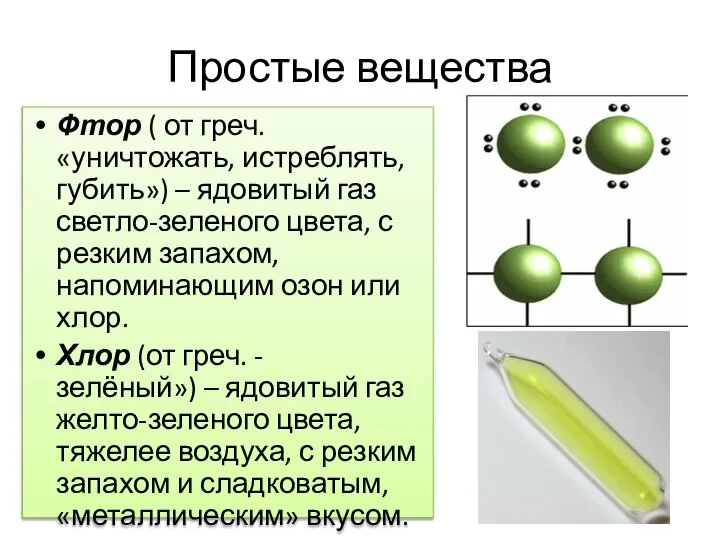
- 3. Простые вещества Фтор ( от греч.«уничтожать, истреблять, губить») – ядовитый газ светло-зеленого цвета, с резким запахом,
- 4. Бром (от др.-греч. «вонючий») - токсичная тяжелая жидкость красно-бурого цвета с сильным неприятным запахом. Йод (от
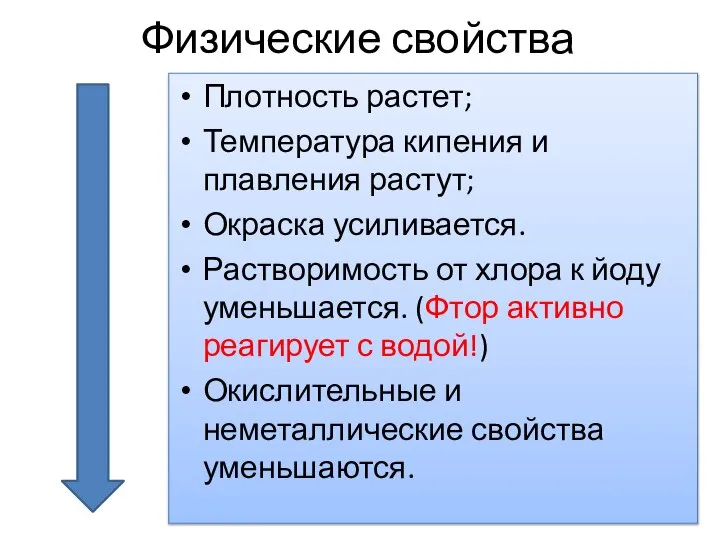
- 5. Физические свойства Плотность растет; Температура кипения и плавления растут; Окраска усиливается. Растворимость от хлора к йоду
- 6. Химические свойства Галогены – типичные окислители. Более активный галоген вытесняет менее активный из его соединений с
- 7. Галогеноводороды HГ – летучие, хорошо растворимые в воде соединения. Водные растворы являются кислотами. Сила кислот от
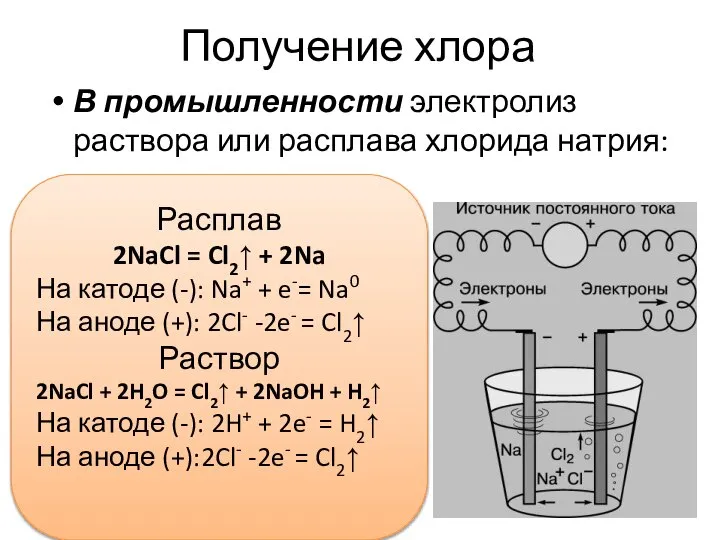
- 8. Получение хлора В промышленности электролиз раствора или расплава хлорида натрия: Расплав 2NaCl = Cl2↑ + 2Na
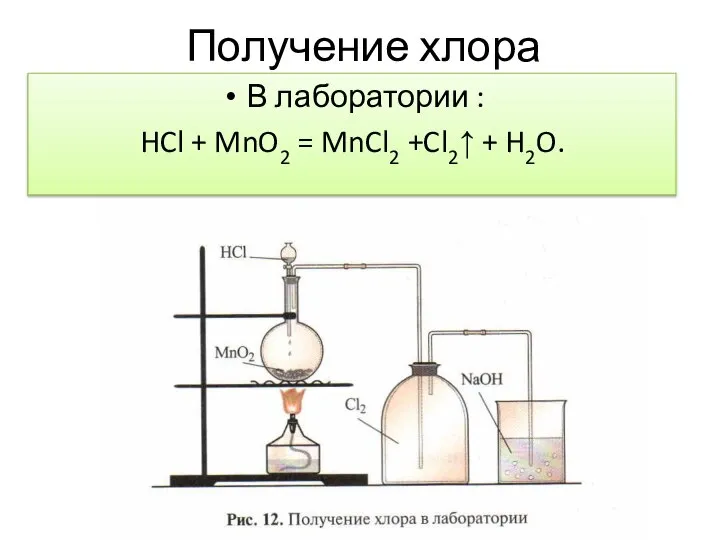
- 9. Получение хлора В лаборатории : HCl + MnO2 = MnCl2 +Cl2↑ + H2O.
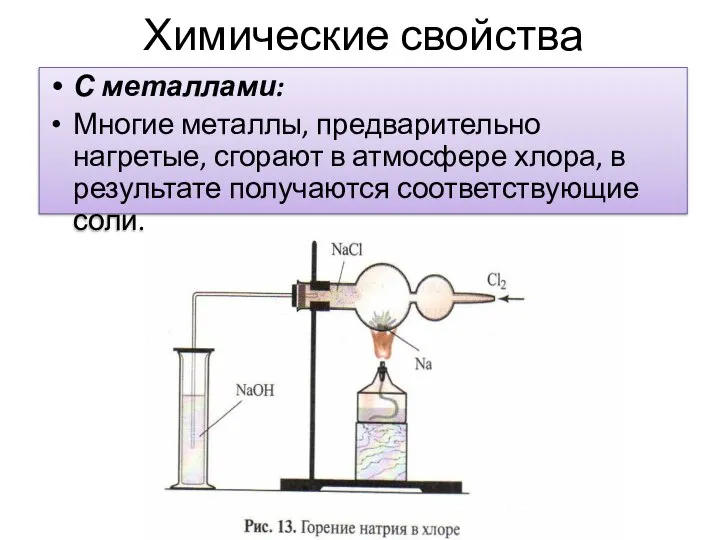
- 10. Химические свойства С металлами: Многие металлы, предварительно нагретые, сгорают в атмосфере хлора, в результате получаются соответствующие
- 12. Скачать презентацию




 Разделение смесей веществ
Разделение смесей веществ Кислоты и их свойства
Кислоты и их свойства Азотсодержащие органические соединения
Азотсодержащие органические соединения Строение атома
Строение атома Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас Химический анализ. Исследовательская деятельность (8 класс)
Химический анализ. Исследовательская деятельность (8 класс) Нахождение молекулярной формулы по данным о массовых долях элементов и относительной молекулярной массе (или молярной массе)
Нахождение молекулярной формулы по данным о массовых долях элементов и относительной молекулярной массе (или молярной массе) Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме
Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме Электролитическая диссоциация
Электролитическая диссоциация Техника безопасности при работе в химическом кабинете
Техника безопасности при работе в химическом кабинете Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9
Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9 Реактор гидроочистки дизельного топлива. Контроль и автоматизация
Реактор гидроочистки дизельного топлива. Контроль и автоматизация Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Химическое сопротивление материалов
Химическое сопротивление материалов Значение химии в медицине
Значение химии в медицине Сера и её соединения
Сера и её соединения Консистентные смазки для легковых автомобилей
Консистентные смазки для легковых автомобилей ФЕНОЛ И ЕГО СВОЙСТВА Учитель химии-биологии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна
ФЕНОЛ И ЕГО СВОЙСТВА Учитель химии-биологии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна Презентация на тему Вредное воздействие нитратов на организм человека
Презентация на тему Вредное воздействие нитратов на организм человека  Щелочноземельные металлы
Щелочноземельные металлы Презентация на тему Из чего сделаны северные трубопроводы
Презентация на тему Из чего сделаны северные трубопроводы  Строение атома
Строение атома Типы химических реакций. Реакции обмена
Типы химических реакций. Реакции обмена Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования:
Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования: Введение в материаловедение
Введение в материаловедение Исследование свойств многоатомных спиртов
Исследование свойств многоатомных спиртов Оксиды. Физические свойства
Оксиды. Физические свойства Презентация 3. Теория ЕГЭ
Презентация 3. Теория ЕГЭ