Содержание
- 2. Комплексные соединения Комплексные соединения - наиболее обширный и разнообразный класс соединений. В живых организмах присутствуют комплексные
- 3. Комплексное соединение состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды,
- 4. История открытия Соединения высшего порядка – так называл знаменитый шведский химик И.Я.Берцелиус (1779-1848) сложные многокомпонентные химические
- 5. Первым подобным соединением, синтезированным в лаборатории, является берлинская лазурь Fe4[Fe(CN)6]. Она была случайно получена художником Дисбахом
- 6. Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным. Соединения с комплексными
- 7. Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например, [Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) . Если
- 8. Правило Сиджвика. (Правило эффективного атомного номера) Английский химик Н.-В. Сиджвик сформулировал эмпирическое правило, согласно которому «устойчивые
- 9. Однако часто наблюдаются отклонения от правила Сиджвика. Например, совершенно устойчивый мономерный ион [Рt(NНз)4] + имеет ЭАН,
- 10. Реакции образования комплексных соединений Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное
- 11. Образование комплексных солей. Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны
- 12. Координационные числа ртути и меди, как правило, равны четырем: Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
- 13. Разрушение комплексных соединений происходит в результате: 1) образования малорастворимого соединения с комплексообразователем: [Cu(NH3)4]SO4 + Na2S =
- 14. 3) образования малодиссоциированного электролита: Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O 4) действия любой
- 15. 5) нагревания некоторых комплексных соединений: [Cu(NH3)4]SO4 = CuSO4 + 4NH3↑ Na3[Al(OH)3] = Na3AlO3 + 3H2O 6)
- 17. Скачать презентацию



![Первым подобным соединением, синтезированным в лаборатории, является берлинская лазурь Fe4[Fe(CN)6]. Она была](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/890675/slide-4.jpg)

![Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например, [Pt(NH3)5Cl]Cl3 – хлорид](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/890675/slide-6.jpg)






![3) образования малодиссоциированного электролита: Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/890675/slide-13.jpg)
![5) нагревания некоторых комплексных соединений: [Cu(NH3)4]SO4 = CuSO4 + 4NH3↑ Na3[Al(OH)3] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/890675/slide-14.jpg)
 Про задачи. Химия 11 класс
Про задачи. Химия 11 класс Галогены. Возможные степени окисления
Галогены. Возможные степени окисления Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Карбонильные соединения
Карбонильные соединения 9 кл Урок 7 Розчинність речовин
9 кл Урок 7 Розчинність речовин Основные химические понятия и законы химии. (Часть 2)
Основные химические понятия и законы химии. (Часть 2) Галогены. Элементы главной подгруппы 7 группы Периодической системы Менделеева
Галогены. Элементы главной подгруппы 7 группы Периодической системы Менделеева Карбоновые кислоты и их производные. (Лекция 11)
Карбоновые кислоты и их производные. (Лекция 11) Вода. Физические и химические свойства
Вода. Физические и химические свойства Презентация на тему Угольная кислота
Презентация на тему Угольная кислота  Идентификация Бензойной кислоты
Идентификация Бензойной кислоты Лучший тест для подготовки к ЕГЭ по химии
Лучший тест для подготовки к ЕГЭ по химии Аммиак. Состав вещества
Аммиак. Состав вещества Реакции этерификации
Реакции этерификации Подготовка к контрольной работе химические реакции 8 класс
Подготовка к контрольной работе химические реакции 8 класс Подача питательной воды в парогенератор при запроектной аварии
Подача питательной воды в парогенератор при запроектной аварии Урок по химии в 10 классе на тему: «Жиры» 2008 год.
Урок по химии в 10 классе на тему: «Жиры» 2008 год. 10-2 основные положения теории Бутлерова
10-2 основные положения теории Бутлерова Номенклатура органических соединений
Номенклатура органических соединений Рівновага в розчинах електролітів. Гідроліз солей. Буферні системи
Рівновага в розчинах електролітів. Гідроліз солей. Буферні системи 7609f31d31514fe19b6df19a98197139 (1)
7609f31d31514fe19b6df19a98197139 (1) Адсорбционно-десорбционные взаимодействия фосфатов кальция и аминокислот
Адсорбционно-десорбционные взаимодействия фосфатов кальция и аминокислот Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Изготовление индикаторной бумаги
Изготовление индикаторной бумаги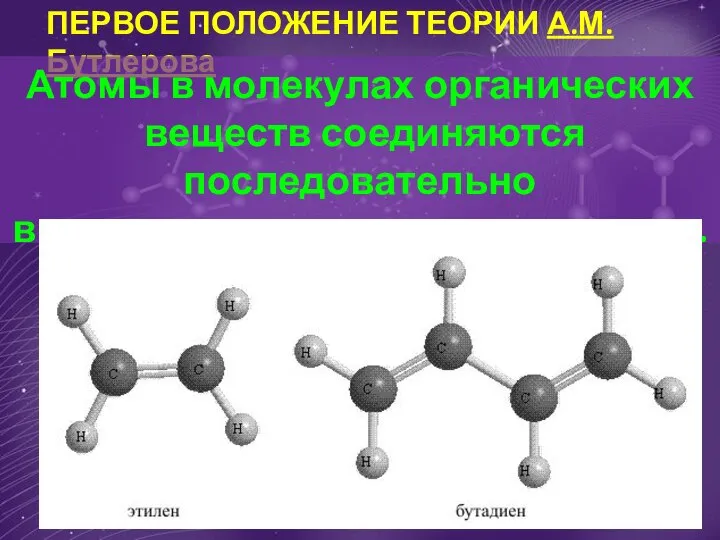 Первое положение теории А.М. Бутлерова Атомы в молекулах органических веществ соединяются последовательно
Первое положение теории А.М. Бутлерова Атомы в молекулах органических веществ соединяются последовательно Валентность
Валентность Консультация по химии
Консультация по химии Презентация на тему Законы газового состояния вещества
Презентация на тему Законы газового состояния вещества