Содержание
- 2. Кислород в природе Строение и аллотропия Физические свойства История открытия Получение Химические свойства Применение Озон Кислород
- 3. В периодической системе кислород расположен в VI группе второго периода. Атом кислорода содержит 8 электронов: 2
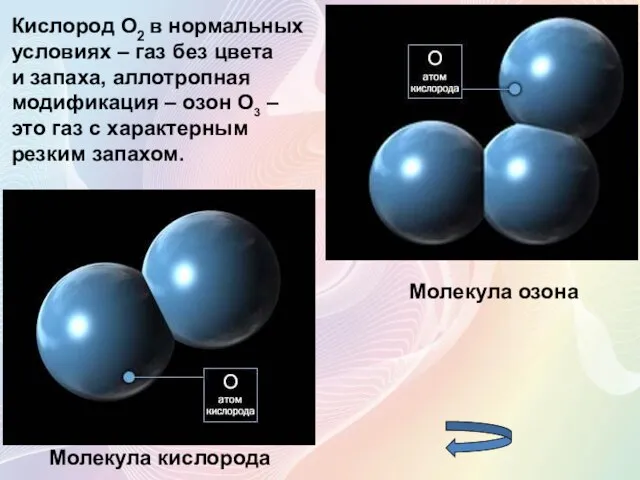
- 4. Кислород О2 в нормальных условиях – газ без цвета и запаха, аллотропная модификация – озон О3
- 5. Кислород мало растворим в воде (примерно 1 объем на 20 объемов воды). При температуре –183°C кислород
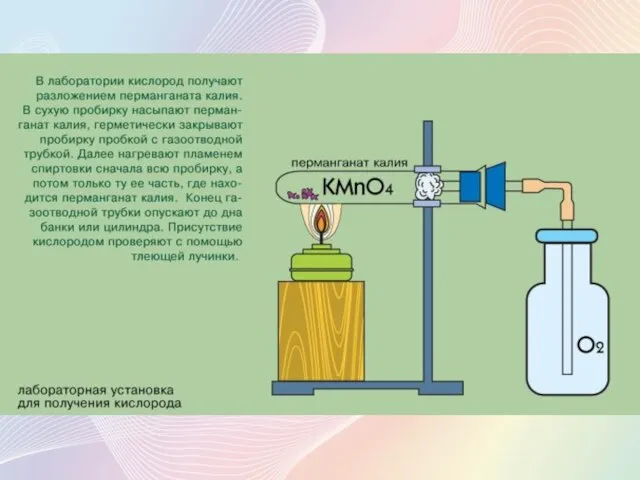
- 6. Получение кислорода В лаборатории: Разложением перманганата калия при нагревании: 2KMnO4 = K2MnO4 + MnO2 + O2
- 8. Получение кислорода В природе кислород образуется в результате процесса фотосинтеза: 6CO2 + 6H2O = C6H12O6 +
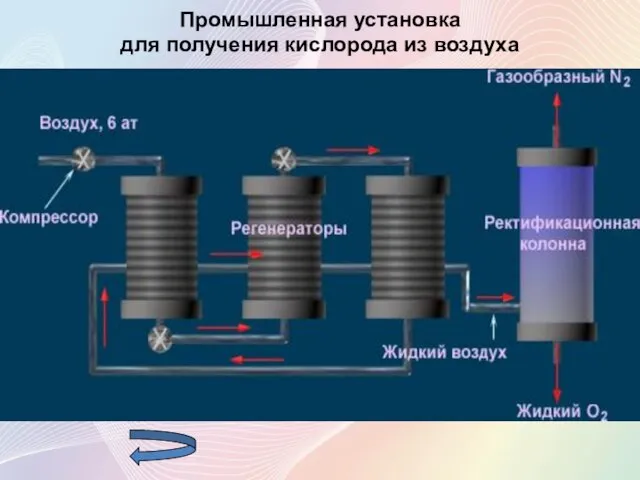
- 10. Промышленная установка для получения кислорода из воздуха
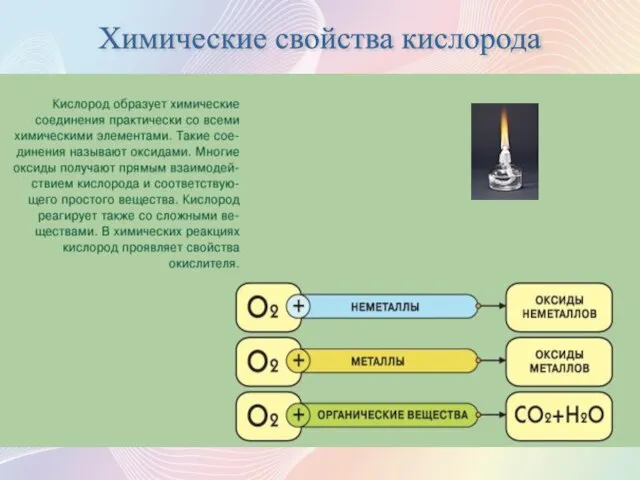
- 11. Химические свойства кислорода
- 12. 1. С неметаллами. При нагревании кислород взаимодействует с водородом, серой, углеродом, фосфором, образуя воду и оксиды:
- 13. 2. С металлами. Очень активно взаимодействуют с кислородом щелочные и щелочноземельные металлы с образованием оксидов и
- 14. 3. В кислороде горят также сложные вещества с образованием соответствующих оксидов: CH4 + 2O2 = CO2
- 15. Кислород очень широко используется в технике, металлургии (при выплавке чугуна и стали, в производстве цветных металлов),
- 16. Озон образуется из кислорода при грозовых разрядах 3О2 = 2О3
- 17. Озон еще более сильный окислитель, чем кислород, так как достаточно неустойчив и может разлагаться с отщеплением
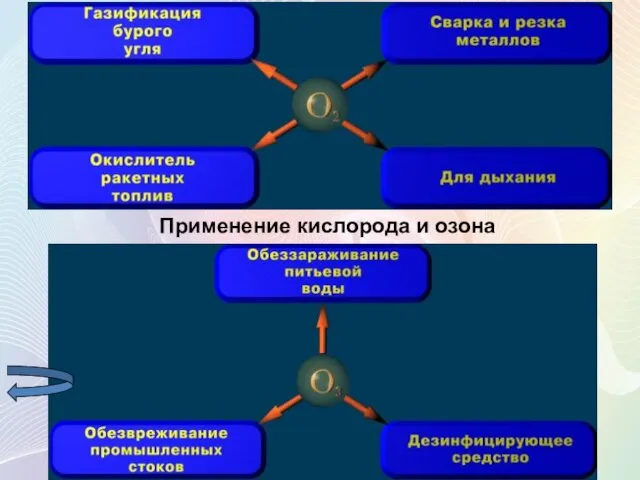
- 18. Применение кислорода и озона
- 19. Кислород - составная часть воздуха
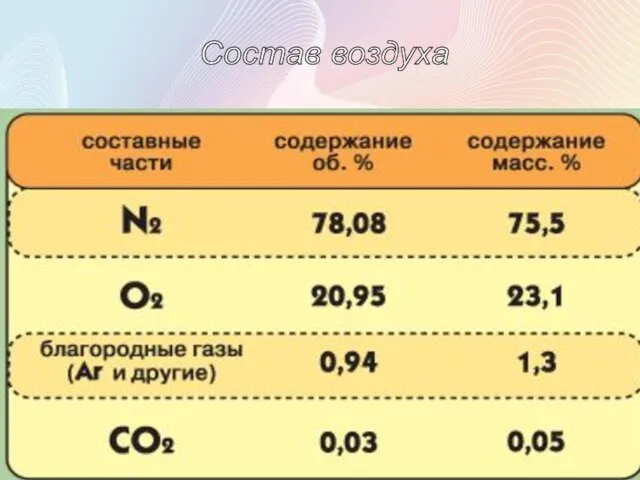
- 20. Состав воздуха
- 22. Скачать презентацию













 Газовые законы
Газовые законы Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Электрическая диссоциация
Электрическая диссоциация Раздел 1
Раздел 1 Жиры. Строение жиров
Жиры. Строение жиров Агрегатные состояния вещества
Агрегатные состояния вещества Любовь и химия
Любовь и химия Создание раствора для ингибирования коррозии черных металлов и его утилизация на удобрения
Создание раствора для ингибирования коррозии черных металлов и его утилизация на удобрения Карбоновые кислоты
Карбоновые кислоты Презентация на тему Моющие и чистящие средства
Презентация на тему Моющие и чистящие средства  Что такое эксперимент?
Что такое эксперимент? Стекло
Стекло Презентация на тему Теория строения органических соединений
Презентация на тему Теория строения органических соединений  Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства
Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства Основания. 8 класс
Основания. 8 класс План для домашней работы по теме Алкадиены
План для домашней работы по теме Алкадиены Серная кислота и для чего используется
Серная кислота и для чего используется Карбонат калия K2CO3
Карбонат калия K2CO3 Неон
Неон Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70
Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70 Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделева
Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделева Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4
Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4 Теория радиационной деформации в некубических металлах: явление анизотропной диффузии
Теория радиационной деформации в некубических металлах: явление анизотропной диффузии Химический анализ воды
Химический анализ воды Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Презентация на тему Неогранические соединения. Периодическая таблица
Презентация на тему Неогранические соединения. Периодическая таблица  Сложные эфиры
Сложные эфиры Висмут
Висмут