Содержание
- 2. ЦЕЛЬ: ЦЕЛЬ: РАССМОТРЕТЬ РЕАКЦИЮ ХИМИЧЕСКОГО РАВНОВЕСИЯ И ИССЛЕДОВАТЬ ВЛИЯНИЕ ВЛИЯНИЯ КОНЦЕНТРАЦИИ(С) ВЕЩЕСТВ НА СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ,
- 3. ТЕХНИКА БЕЗОПАСНОСТИ НА УРОКАХ
- 4. ОБЩИЕ ПОЛОЖЕНИЯ. ОРГАНИЗАЦИЯ РАБОЧЕГО МЕСТА 1. ПРОЧИТАЙТЕ ВНИМАТЕЛЬНО ЗАДАНИЕ ПО ПРАКТИЧЕСКОЙ РАБОТЕ. 2. СТРОГО ВЫПОЛНЯЙТЕ УКАЗАННЫЕ
- 5. Все самопроизвольно протекающие реакции можно разделить на две группы: обратимые и необратимые. Необратимые реакции проходят только
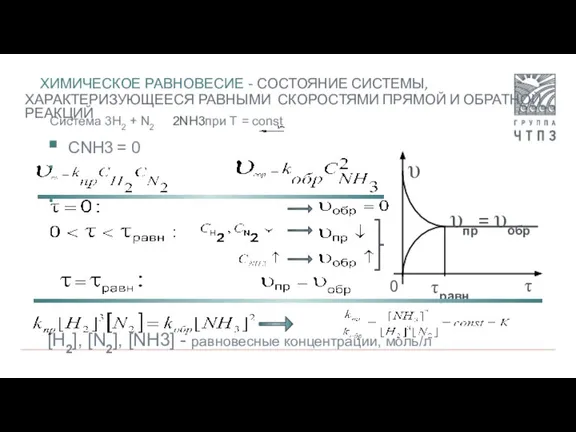
- 6. ХИМИЧЕСКОЕ РАВНОВЕСИЕ - СОСТОЯНИЕ СИСТЕМЫ, ХАРАКТЕРИЗУЮЩЕЕСЯ РАВНЫМИ СКОРОСТЯМИ ПРЯМОЙ И ОБРАТНОЙ РЕАКЦИЙ Система 3H2 + N2
- 7. Влияние концентраций веществ на состояние равновесия системы CH4(г) + 2H2O(г) CO2(г) + 4H2(г) Увеличение концентрации CH4
- 8. ВЛИЯНИЕ ОБЩЕГО ДАВЛЕНИЯ В СИСТЕМЕ Давление оказывает влияние на равновесие реакций, сопровождающихся изменением количеств газообразных веществ
- 9. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СОСТОЯНИЕ РАВНОВЕСИЯ Нагревание смещение равновесия в сторону эндотермических реакций Охлаждение смещение равновесия в
- 10. ВЫПОЛНЕНИЕ ПРАКТИЧЕСКОЙ РАБОТЫ
- 12. 5/17/2016 adasdfsdzfvzx
- 13. 5/17/2016 adasdfsdzfvzx
- 14. 5/17/2016 adasdfsdzfvzx
- 15. 5/17/2016 adasdfsdzfvzx
- 16. В ОТЧЁТЕ ПО ПРАКТИЧЕСКОЙ РАБОТЕ ДОЛЖНО БЫТЬ ЗАПИСАНО: 1.Название работы 2.Цель работы 3.Оборудование 4. Выполнение практической
- 18. Скачать презентацию














 Осуществление цепочки химических превращений. Практическая работа №1
Осуществление цепочки химических превращений. Практическая работа №1 Основы химической термодинамики и термохимии. Лекция 5
Основы химической термодинамики и термохимии. Лекция 5 Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Круговорот серы в природе
Круговорот серы в природе Классификация неорганических веществ
Классификация неорганических веществ Железо и его соединения
Железо и его соединения Дизайн молекулярных магнетиков
Дизайн молекулярных магнетиков Открытый урок химии. Типы химических реакций
Открытый урок химии. Типы химических реакций Практическая работа №5. Качественные реакции на анионы 1-3 групп
Практическая работа №5. Качественные реакции на анионы 1-3 групп Особенности строения алкенов
Особенности строения алкенов Белки. Структуры белков
Белки. Структуры белков Химические реакции в органической химии
Химические реакции в органической химии План для домашней работы по теме Алкадиены
План для домашней работы по теме Алкадиены Презентация на тему Каучуки
Презентация на тему Каучуки  Степень окисления
Степень окисления Строение вещества
Строение вещества Оксиды неметаллов и металлов. Состав и названия
Оксиды неметаллов и металлов. Состав и названия 01. Химический состав
01. Химический состав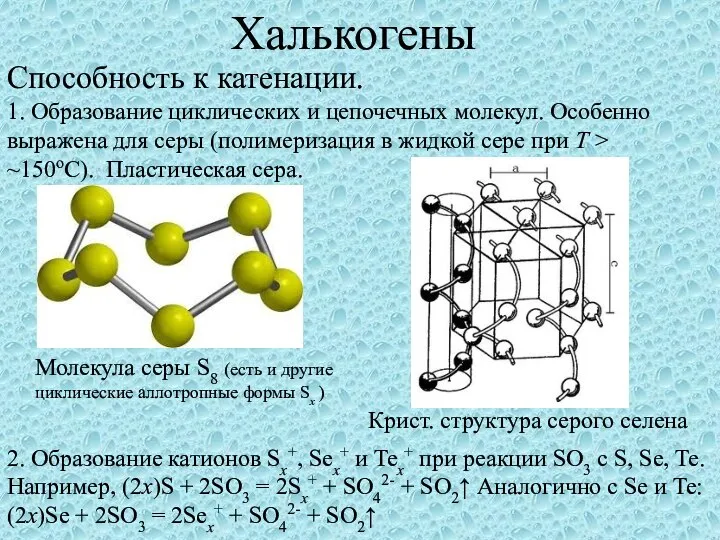 Халькогены. Способность к катенации
Халькогены. Способность к катенации Виды оксидов азота
Виды оксидов азота Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік
Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік Кристаллические решетки, вид связи и свойства веществ
Кристаллические решетки, вид связи и свойства веществ Электронная конфигурация атома
Электронная конфигурация атома Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Оксиды. Физические свойства
Оксиды. Физические свойства Графит. 9 класс
Графит. 9 класс Кислоты
Кислоты